세포 외 소포체(Extracellular vesicle, EV)의 치료적 기능이 점차 밝혀지면서, 이를 치료제로 이용하기 위한 연구들이 진행되고 있습니다. 그러나, 항체, 펩타이드, 화학 물질들과 다르게 단일 성분만으로 구성된 물질이 아니라는 점, 또 생체 유래 물질이기에 구성 물질의 조성에 변동이 있을 수 있다는 점, 여러 물질의 특성이 섞여 한 가지의 고정 정량법으로는 정량이 어렵다는 점 때문에 의약품으로서의 EV 응용이 어려움을 겪고 있습니다.
따라서 EV의 정량과 특성 분석을 위해서는, 일반적으로 사용되어 왔던 기준 정량법 등 만을 사용하는 것이 아니라, 더 발전한 최신 기술이 필요하며, 이들 또한 단 하나의 분석법이 아닌 다양한 접근법을 조합하여 종합적으로 EV를 분석하는 것이 필요합니다.
오늘 본문에서는 EV 분석을 위해 사용할 수 있는 다양한 정량법과 그 구성 물질들의 특성 조사법에 대해서 정리해보려고 합니다.
- EV 정량법
1) 나노 입자 추적 분석기 (Nanoparticle Tracking Analysis, NTA)
NTA는 브라운 운동 법칙에 따라, 부유 입자들로 인해 산란된 빛을 감지해 입자의 농도를 측정하는 기기입니다. 가장 일반적으로 EV의 수를 측정하기 위해서 사용되는 장비이며, 시료에 부유하고 있는 엑소좀에 레이저 빔을 조사하여 산란된 빛을 CCD 카메라를 통해 녹화하는 원리입니다.
카메라에 녹화된 영상을 기반으로 입자 농도를 계산하기 위해 스토크스-아인슈타인 방정식이 적용되며, 계산 결과는 단위 입방 센티미터당 입자수로 표현됩니다. NTA는 전처리 과정이 필요하지 않고 시료 그대로를 이용하여 분석을 진행하기 때문에 EV의 수를 확인하고 계산하는데 용이합니다. 형광 모드를 이용할 경우, 형광 표지자가 없는 EV는 감지되지 않아 특정 EV 특이적인 정량이 가능하며, 기기의 입자 크기 측정 범위가 30-500nm로 한정되므로, 500nm 이상의 EV는 측정할 수 없어 세포 사멸 소체(apoptotic body) 등의 큰 소포체와 구분하여 정량이 가능합니다. 그러나, 유사한 크기를 가진 지단백질(lipoprotein)의 경우 EV와 동시에 계수되어 계산 결과에 영향을 미칠 수 있습니다.
NTA를 통해 반복성이 보장된 결과를 얻기 위해서는 고가의 장비와 이에 대한 전문적인 이해가 필요하다는 지식적 장벽이 존재합니다. 또한 형광 염료에 대한 광표백(photobleaching)과 백그라운드 시그널이 분석 결과의 불확실성을 더할 수 있습니다. 따라서 해당 장비를 이용하여 EV를 측정할 때에는 지정된 가이드라인에 따라 정확하고 철저하게 측정되어야 합니다.
2) 유세포 분석기 (Flow cytometry)
많은 실험실에서 사용되고 있는 유세포 분석기 또한 EV를 측정하는 한 가지 방법이 될 수 있습니다. 이는 유세포 분석기가 동시에 다양한 파라미터에 대한 분석을 진행할 수 있기 때문입니다. 그러나 장비의 크기 측정의 한계 때문에, 일반적인 유세포 분석기로는 300nm보다 작은 입자에 대한 측정이 불가능합니다.
따라서 300nm보다 작은 EV의 수를 계산하기 위해서는 항체를 이용할 수 있습니다. EV과 결합한 비드(bead)에 형광이 결합된 2차 항체까지 붙인 후, 비드를 단일 입자 상태로 검출기에 주입합니다. 검출기에서 레이저가 비드에 조사되면, 비드에 결합된 형광이 활성화되어 이들이 방출한 빛을 형광 검출기가 감지합니다. 이때 감지된 형광의 세기에 따라 ‘이벤트’ 수가 계수되며, 비드의 수, 즉 EV의 수를 계산하게 됩니다.
그러나 유세포 분석기를 이용한 EV의 정량에서 가장 큰 문제점은, 분석 과정 중 시료의 온도가 상승한다는 점입니다. 이는 EV의 상태에 변화를 일으킬 수 있어, 결과에 영향을 줄 수 있는 요인이 되기도 합니다. 또한 매우 작은 입자들이 뭉쳐 하나의 이벤트로 계산되는 경우, 측정치가 감소하는 효과를 줄 수 있으며 이는 작은 입자들이 지나치게 많을 경우 발생할 수 있습니다.
3)조정 가능한 저항 펄스 감지 (Tunable resistive pulse sensing, TRPS)
TRPS는 특정 입자를 감지하기 위해 막의 구멍을 통과하는 전압을 이용합니다. EV 시료를 막의 한쪽에 위치시키면 단일 입자 상태의 EV가 구멍까지 이동하고, 이 때문에 증가한 구멍 내 저항으로 인해 내부 전류가 감소하도록 유도합니다. 막 구멍을 통과하는 입자의 개수와 크기는 이때 변화하는 전류의 변화를 분석하여 도출할 수 있습니다. 하나의 ‘이벤트’는 1마이크로암페어의 전류의 감소로 정의하며, 이벤트 수는 EV의 수로 환산할 수 있습니다.
이 기술은 반복된 사용을 통해 막 구멍이 막힐 수 있다는 점, 민감도가 떨어져 작은 크기의 엑소좀은 검출할 수 없다는 단점 등을 갖고 있습니다.
4) 전자 현미경 (Electron microscopy)
분리된 EV의 순도와 온전함을 증명할 수 있는 가장 직관적인 방법은 전자현미경을 이용하는 것입니다. 전자 현미경을 사용한 EV의 형태의 이미징을 위해, 전체 장착 음성 염색법(whole-mount negative staining)을 이용하여 시료의 전처리 과정을 거치는데, 이 과정에서 EV가 건조되어 컵 모양을 보입니다. 이러한 형태의 변화를 피하기 위해 초저온 투과 전자 현미경(Cryo-EM)을 이용한 이미징을 진행하기도 합니다. 이 외에도 차단 절편법(Blocking sectioning), 플라스틱 포매(Plastic embedding), 글루타르알데하이드(Glutaraldehyde)를 이용한 고정법을 통해 EV의 원래 형태를 보존하며 관찰할 수 있습니다.
5) 동적 광산란 (Dynamic light scattering, DLS)
DLS 또한 NTA 못지 않게 나노입자의 크기를 확인하는 방법으로서 널리 사용되고 있습니다. 용액 속 입자들은 브라운 운동을 하며 랜덤하게 서로 충돌하여 에너지를 교환하는 과정을 거칩니다. 이때, 전방향에서 조사된 빛이 입자에 부딪혀 산란되고, 산란된 빛이 특정 각도의 검출기에 감지되는 광자의 세기를 통해 입자의 크기와 농도를 산출합니다. 산란된 광자의 세기는 입자가 작아 빠르게 이동할수록 더 불안정하게 측정됩니다. 입자의 크기는 스토크스-아인슈타인 방정식을 이용해 계산하며, 이를 통해 계산된 다분산성(polydispersity)이 0.1보다 작으면 시료의 모든 입자들이 같은 크기라는 것을 의미합니다.
6) 미세 유체 장치 (Microfluidics)
미세유체장치에서는 마이크론 크기의 채널을 통해 유체의 부피를 마이크로리터에서 밀리리터까지 조절할 수 있습니다. 세포 배양 배지부터 환자에게서 얻은 체액까지, 다양한 유래에서의 EV를 정량할 수 있고, 그 특성을 분석할 수 있는 도구로서 사용됩니다. 프로그래밍된 펌프 시스템을 통해 면역 포획(immunocapture)된 EV를 계수하여 수율을 계산하는 방식으로, 이는 매우 적은 양의 시료를 통해서도 정량할 수 있다는 장점이 있어 매우 실용적이고, 경제적이며 직관적인 방법이라고 할 수 있습니다. 해당 정량법을 통해 miRNA까지 분석하고 정량할 수 있다는 실험 결과가 밝혀지면서, 미세유체장치를 통한 분석법의 감도가 매우 높다는 것이 충분히 증명된 바 있습니다.
7) 표면 플라스몬 공명 (Surface plasmon resonance, SPR)
SPR은 굴절률 차이로 인해 물질 표면과 입사광 사이에서 발생하는 공명 전자 전동이 원리로 사용되는 정량법입니다. 이는 시료에 특별한 표지 없이도 입자를 검출해낼 수 있는 방법이며, 일반적으로 생체 분자 사이의 상호작용을 연구하는 방법으로 사용되었습니다. EV의 정량을 위해서는 항-CD63 항체 등을 감지하는 SPR 센서를 이용하여 그 농도를 측정할 수 있으며, 측정치 의 오차범위는 약 ±50%인 것으로 나타났습니다.
8) 단일 입자 간섭 반사 영상 센서 (Single-particle interferometric reflectance imaging sensor, SP-IRIS)
해당 기법을 활용할 경우, 50nm 이상인 EV의 서로 다른 집단에 대한 표현형 분석과 디지털 방식의 계수가 가능합니다. 이산화규소(SiO2)층에서 반사된 IRIS 신호는 필드 간섭의 영향을 받습니다. IRIS는 고효율로 생물량을 측정할 수 있으며, 별도의 표지 없이 대규모의 단일 입자들을 디지털 방식으로 확인할 수 있습니다.
여기까지 확인한 것처럼, 입자의 정량법에는 다양한 기법들이 사용될 수 있으나 일부 작은 EV에 대해서는 민감도가 떨어지는 정량법들이 일부 존재합니다.
- EV 특성 분석
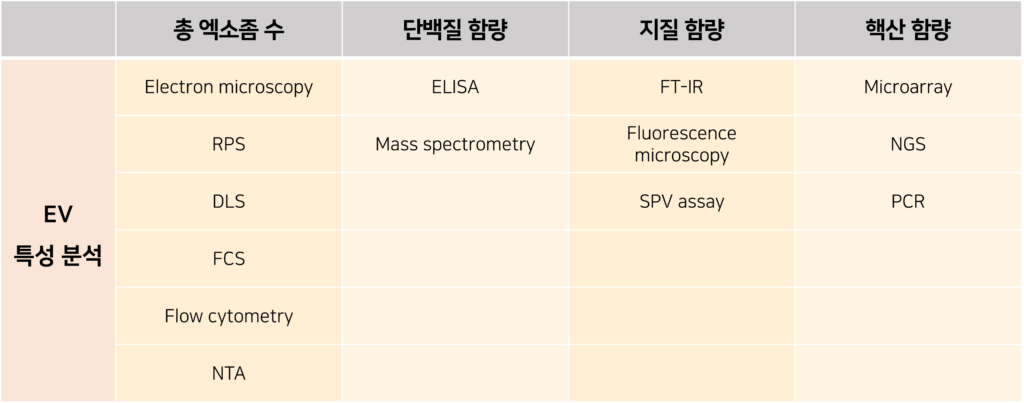
분리된 EV의 수를 계수하는 것처럼, EV를 구성하고 있는 생체 분자(핵산, 지질, 단백질)에 대한 정량 분석과 정성 분석 또한 수행되어야 합니다. 이어지는 내용에서는 대표적으로 평가해야 하는 항목들에 대해서 살펴보고, 해당 항목들을 분석할 수 있는 기법들을 소개해보겠습니다.
1) 총 EV 수 (Total EV count)
입자 수를 측정하는 방법은 EV의 수율을 계산하는데 사용되며, 전자 현미경, RPS, DLS, 형광 상관 분석법(Fluorescence correlation spectroscopy, FCS), 유세포 분석기, NTA 등을 이용하여 측정할 수 있습니다. FCS, 유세포 분석기, NTA가 가장 많이 사용되는 기법이며, DLS와 RPS는 입자수를 초과 측정하여 수치의 신뢰도가 떨어집니다.
2) 단백질 함량 (Protein content)
EV의 순도는 시료가 포함하고 있는 단백질의 함량을 분석함으로써 평가할 수 있습니다. EV의 총 입자 수에 대한 단백질의 총량을 계산했을 때 해당 시료의 순도를 나타낼 수 있습니다. EV의 단백질 마커 또한 효소면역측정법(Enzyme linked immunosorbent assay, ELISA) 또는 질량분석기(Mass spectrometry, MS)를 통해 검출할 수 있습니다.
MS는 복잡한 혼합물이더라도, 이온의 비전하(mass-to-charge ratio)를 측정하여 물질들을 분리하여 효율적으로 분석할 수 있는 기기입니다. 분석 과정 중에 EV의 물질들이 분해되고 변질되는 것을 막기 위해, EV의 단백질 분석을 위해 MS를 이용하는 경우 최소한의 전처리를 거쳐 분석이 진행됩니다. EV 특이적 단백질은 MS와 생물정보학을 통해 전체적으로 분석됩니다.
ELISA는 보다 일반적으로 사용되는, 항체를 이용한 단백질과 펩타이드의 정량 분석법입니다. EV의 단백질 마커와 EV의 종양 항원, 그리고 EV 특이적 항원의 정량은 ELISA 덕분에 가능하며, EV의 프로파일링과 진단을 위해서도 사용되어 왔습니다. 일부 단백질 표지자들은 ELSIA를 통해 저비용으로 분석할 수 있으며, 복잡한 생물학적 샘플 내부에 있는 단백질의 정량은 MS를 통해 이루어질 수 있습니다.
3) 지질 함량 (Lipid composition)
EV는 이들이 운반하는 지질의 종류에 따라 몇 개의 하위 집단으로 분류할 수 있습니다. 이러한 관점에서의 EV의 순도는 전체 EV 수에 대하여, 타겟하는 지질을 포함하는 EV의 비율을 계산하여 평가할 수 있습니다. 지질 함량 분석법으로는 푸리에 변환 적외선 분광법(Fourier Transform Infrared Spectroscopy, FT-IR)과 형광 현미경, 황산-인산-바닐린 분석법(Sulfo-Phospho-Vanillin assay, SPV)이 있습니다. 지질 농도는 SPV 분석법으로 측정할 수 있는데, 황산이 존재하는 조건 하에서 인산 바닐린과 지질의 카르보늄 이온의 반응을 통해 생성된 색조 물질을 통해 측정하는 방식의 분석법입니다. EV의 지질을 직관적으로 확인하기 위해서는 세포막 지질 친화적인 염료인 PKH26 또는 DiR을 이용하여 염색한 뒤, 형광 현미경으로 확인할 수 있습니다.
SPV 분석법이나 형광 현미경과 비교하여, FT-IR은 지질 농도에 대한 분석 정확도가 높고 반복성이 보장된 기법이며, 분석 속도와 비용, 그리고 필요한 시료의 양에서도 분석에 매우 용이한 방법입니다. 그러나 FT-IR은 콜레스테롤이나 다른 스테롤 계열의 지질에 대한 민감도가 떨어지는데, 이들의 C-C 또는 C-H 결합의 진동 밴드가 다른 혼합물에 의해 방해받기 쉽기 때문입니다.
4) 핵산 함량 (DNA/RNA analysis)
세포 간의 DNA/RNA 운반을 위해 EV가 운송 수단으로 사용되기도 합니다. EV의 순도는 전체 EV 양에 대하여, 타겟 DNA/RNA 시퀀스를 보유한 EV의 수를 계산하여 평가할 수 있습니다. 마이크로어레이(Microarray), 차세대 염기서열 분석(Next-generation sequencing, NGS), 중합효소 연쇄 반응(Polymerase chain reaction, PCR) 등의 방식이 일반적으로 EV의 핵산 연구에서 많이 사용되는 분석법입니다. NGS, 마이크로어레이 기술과 비교했을 때, PCR이 가진 뛰어난 민감도와 정확도 때문에 PCR이 가장 기본적인 분석법으로 사용되는 추세입니다.
여기까지 EV의 정량법, 그리고 특성 분석 파트로 나누어 의약품으로서 EV를 활용하기 위해 필요한 프로파일들과 기법들을 정리해보았습니다. 아직까지 기준 정량법/분석법은 정립되지 않았지만, 점차 발전을 거듭하고 있는 분석 기술의 도입으로 더욱 정확한 EV의 분석이 가능해지고 있습니다. 중요한 것은, EV가 복잡한 구성 물질과 기능을 갖고 있는 만큼, 여러 원리를 이용한 다양한 분석법을 응용하여 EV에 대한 종합적 분석과 판단이 필요하다는 점입니다. 엄격한 의약품 규제를 넘어서기 위해, 다양한 분야와의 협업을 통한 EV 의약품의 상용화를 기대해봅니다.
출처 : Miron RJ, Zhang Y. Understanding exosomes: Part 1-Characterization, quantification and isolation techniques. Periodontol 2000. 2024 Feb;94(1):231-256. doi: 10.1111/prd.12520.
