질량 분석법(Mass spectrometry, MS)은 높은 감도와 빠른 분석 속도를 강점으로 내세워 신약개발 분야에 필수적인 분석법으로 자리잡았습니다. 예를 들어, 약물의 타겟으로 사용되는 단백질의 경우 혼합물 속에 저농도로 섞여 있어 정량이 어렵지만, MS로는 정확한 농도 분석이 가능합니다. 또한 대량신속처리분석(High-throughput analysis)도 MS에 의해 자동화, 단순화되어 정확하고도 빠르게 결과를 도출해낼 수 있습니다. 이러한 장점을 통해 체액에서의 바이오마커 추적, 약물-타겟 결합 스크리닝 등에도 적용되고 있습니다.
사실, ‘질량’ 분석법이라는 용어는 잘못 표기되었다고 할 수 있습니다. 실제 질량분석법은 물질의 질량을 측정하는 것이 아니라, 단위전하 당 질량(mass-to-charge, m/z)을 측정하기 때문입니다. 따라서 실제 MS의 측정 단위는 질량의 단위가 아닌, 킬로그램 퍼 쿨롱(kilograms per Coulomb)입니다. 측정 단위에서 알 수 있듯 MS는 이온 분자를 분석하는데, 동위원소의 존재 때문에 일반적으로 우리가 알고 있는 분자량과 MS의 결과값은 동일하지 않습니다.
기본적으로 MS 시료는 기체상의 이온 상태에서 분석됩니다. 이를 위하여 실제 질량분석기에서 시료 분석 이전에, 시료의 이온화 단계를 필요로 합니다. 이러한 일련의 과정을 위해 MS의 단위체는 이온화 장치(Ion sources), 질량분석기(Analysers), 측정기(Detector)의 세 가지로 나눌 수 있습니다.
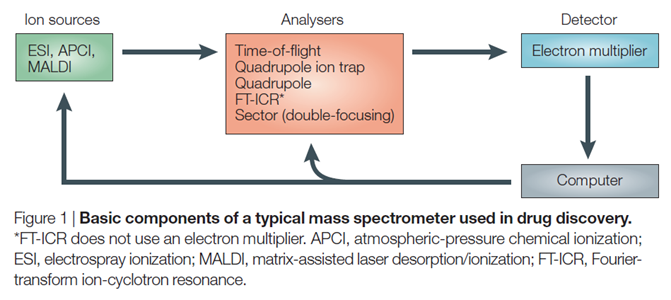
분석 장치 내의 시료의 흐름에 따라, 이온화 장치에 대해서 먼저 알아보겠습니다. 앞서 언급된 것처럼, 시료는 기체상 이온으로 분해되어 진공화된 MS 내에서 분석됩니다. 따라서 시료를 반응시켜 기체상의 이온으로 만들어 내는 과정이 매우 중요합니다. 전통적으로 사용되어왔던 이온화 프로세스는 두 단계로 진행되는데, 먼저 시료의 휘발, 그리고 이온화 과정으로 이루어집니다.
이때 고온의 휘발 단계 때문에, 분석 가능한 시료의 범위가 저분자 물질로 한정된다는 한계가 있습니다. 그러나 대부분의 생체 분자들이 고분자인 데다가, 높은 극성을 갖고 있어 휘발되는 데에 어려움을 겪습니다. 그러나 기술의 발전으로, 온도에 민감한 비휘발성 분자들도 기체상 이온으로 변환할 수 있게 되었습니다. 이러한 기술로 크게 두 가지의 방법이 사용되는데, 전기분무 이온화(Electrospray ionization, ESI)와 기질 보조 레이저 탈착 이온화(Matrix-assisted desorption ionization, MALDI) 법입니다.
◎ 전기분무 이온화(ESI)
ESI는 말그대로 분사 방식을 사용하며, 용매에 용해되어 있는 시료가 대기압에서 내경 250um 이하의 작은 관을 통과하면서 이온으로 변환됩니다. 여기에서 사용되는 작은 관은 반대편 전극과 +500 ~ +4500V의 전압차를 가지며, 실제 전압은 관의 내경과 용매에 따라 달라지기도 합니다. 일반적으로 높은 기화점을 가진 시료일수록 높은 전압차가 필요합니다. 일단 시료가 분사되면 전하를 띄는 에어로졸이 생성되는데, 이 과정에서 질소 기체가 이용됩니다. 분사 단계에서 시료는 양전하 또는 음전하의 용매와 용질로 분리되고, 결과적으로 시료가 용매와 분리되어 이온 상태로 존재하게 됩니다. 이렇게 이온화된 시료는 질량분석기로 흘러갑니다.
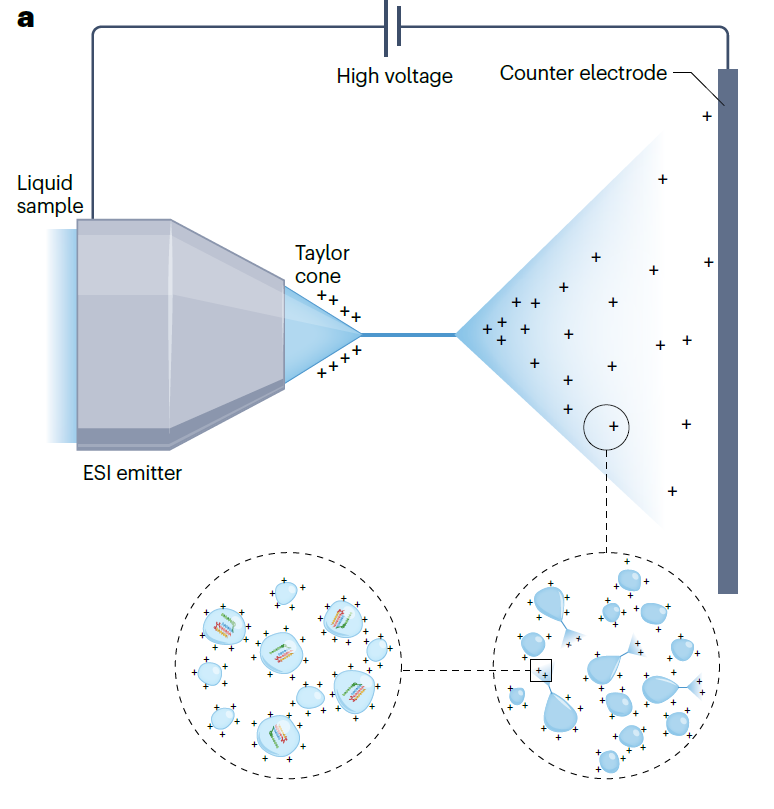
ESI가 생체분자의 이온을 생성하는 핵심 원리는 양성자화/탈양성자화(protonation/deprotonation)입니다. 산 또는 염기성을 가지는 단백질, 펩타이드, 올리고뉴클레오타이드 등과 같은 생체 분자의 이온은 여러 개의 양성자화/탈양성자화 부위를 갖고 있습니다. 따라서 각 부위의 양성자화/탈양성자화 여부에 따라 질량 스펙트럼에서 여러 개의 피크(peak)를 나타냅니다. 언뜻 보기에는 여러 피크를 보이고 있어 분자량을 분석하기 어려워 보이지만, 사실 이 때문에 보다 정확한 질량 측정이 가능합니다.
또한 다중 전하 상태를 이용하면 고분자 물질의 분석도 가능합니다. 예를 들어, 사이토크롬 c (Cytochrome C)는 분자량이 12,350Da이지만, 10-20개의 양성자가 추가되면 해당 단백질의 m/z 비율이 2,000 미만으로 내려가, 대부분의 질량 분석기의 작업 범위 내에 포함되어 분석이 진행될 수 있습니다. ESI를 통해 이온화가 될 수 있는 분자의 크기에 제한은 없는 것으로 알려져 있으며, 비공유 복합체(단백질 복합체, 이중가닥 DNA, 단백질-약물 복합체, DNA-약물복합체)가 손상되지 않고 이온화됩니다.
그러나 계속해서 시료를 한 방향으로 흘려주어야 하는 기기 특성 상, 시료의 소비가 지속적으로 발생해 일정량의 시료가 낭비될 수 있습니다. 또한 1mM 이상의 염을 포함하는 고농도의 시료일 경우, 이온 생성이 어려워 분석의 정확도가 떨어진다는 단점이 있습니다.
이러한 한계를 보완할 수 있는 유사한 기술로 대기압 화학 이온화 (Atmospheric-pressure chemical ionization, APCI)가 있습니다. ESI에서는 분사를 위해 전압을 사용한 반면, APCI에서는 질소와 열을 이용하며 코로나 방전을 이용한 연쇄반응을 통해 시료의 이온화가 진행되므로 염에 대한 민감도가 높지 않고 약한 극성 분자도 쉽게 이온화가 가능하다는 장점이 있습니다. 그러나 ESI와 달리 열을 이용한다는 특성에 따라, 온도에 민감한 물질의 분석이 어렵고 고순도의 시료를 요구한다는 제한이 있어, ESI와 상호보환적인 기술로 사용할 수 있습니다.
◎ 기질 보조 레이저 탈착 이온화 (MALDI)
시료의 이온이 계속해서 주입되는 ESI와는 다르게, MALDI에서의 이온은 펄스 레이저를 통해 생성됩니다. 시료는 MALDI의 레이저 파장을 흡수하는 고체 매트릭스와 함께 프로브(Probe)에 결정 상태로 혼합됩니다. 이 프로브에 레이저가 조사되면 매트릭스 분자가 에너지를 흡수하고, 탈착된 시료에 양성자화가 이루어지며 기체상 이온이 생성되어 ESI와 유사한 방식으로 질량분석기로 진입하는 원리입니다.
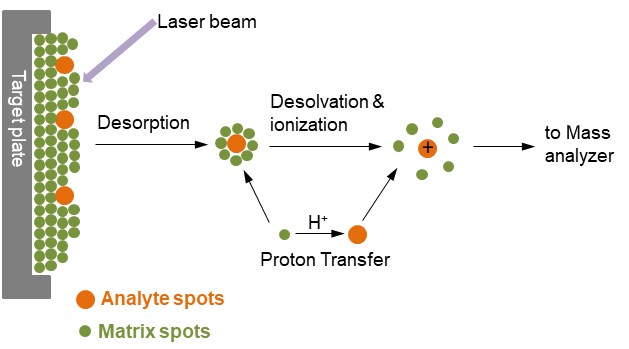
단일 양성자화 된 시료가 일반적으로 생성되지만, 이온이 생성되는 정확한 메커니즘은 아직 전부 밝혀지지 않았습니다. ESI와의 차이점은 레이저가 펄스 패턴으로 조사되어 각각의 이온이 별개로 형성되므로 시료의 낭비가 없다는 점입니다. 또한 하나의 양성자로 전하가 부여된 시료가 발생하므로, TOF(Time of flight) 형태의 질량 분석기와 결합할 경우 시료의 빠른 분석이 가능하다는 장점이 있습니다. 더하여 염과 용매에 대한 저항성이 상대적으로 높아, 세포용해물에서 단백질을 바로 이온화 할 수도 있습니다.
그러나 펄스 패턴의 이온화 장치와 맞지 않는 질량분석기와는 결합이 어렵다는 단점이 있으며, MALDI에서 사용되는 매트릭스는 500Da에서 심한 화학적 노이즈를 발생시켜 저분자 물질에 대한 분석이 어렵습니다. 이를 극복하기 위해 Desorption/ionization on silicon(DIOS) 시스템으로 노이즈를 줄여 저분자 물질의 분석을 용이하게 합니다.
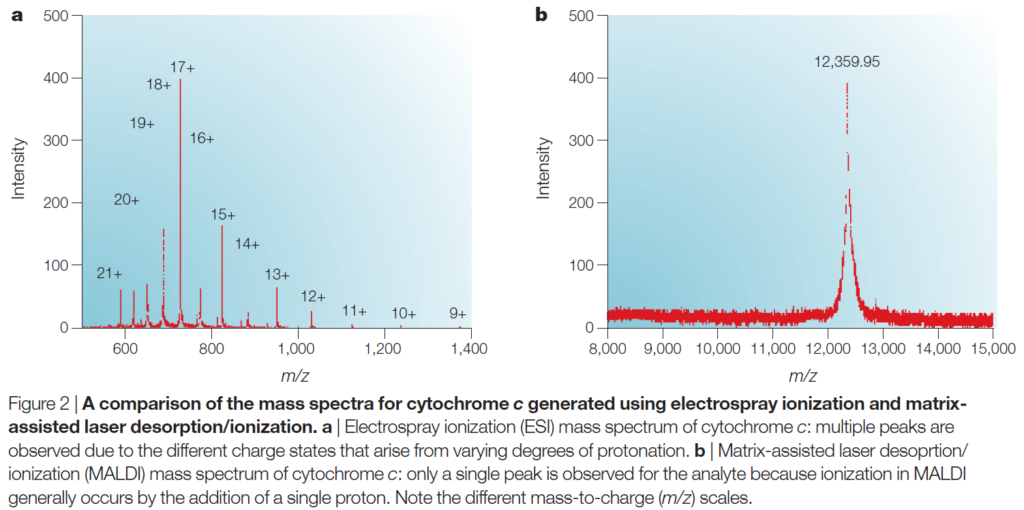
아래의 두 그래프는 사이토크롬 C를 ESI, MALDI 두 가지 방식으로 이온화하여 나타낸 그래프입니다(좌: ESI, 우: MALDI). ESI법을 이용한 경우, 해당 단백질 분자가 갖고 있는 다수의 양성자화/탈양성자화 부위의 이온화 여부에 따라 여러 개의 피크가 나타나는 반면, MALDI법을 이용한 경우 단 하나의 양성자로 이온화가 진행되어 그래프에서도 하나의 피크만을 확인할 수 있습니다.
이처럼, 분석하고자 하는 시료의 특성과 분석 목적에 따라 이온화 방법을 선택하여 질량 분석을 진행할 수 있습니다. 다음 글에서는 이온의 비전하(m/z)를 측정하는 질량 분석기의 종류와 원리에 대해 알아보도록 하겠습니다.
참고문헌 : Glish, G., Vachet, R. The basics of mass spectrometry in the twenty-first century. Nat Rev Drug Discov 2, 140–150 (2003). https://doi.org/10.1038/nrd1011
Figure 2: Prabhu, G.R.D., Williams, E.R., Wilm, M. et al. Mass spectrometry using electrospray ionization. Nat Rev Methods Primers 3, 23 (2023). https://doi.org/10.1038/s43586-023-00203-4
Figure 3: https://www.creative-proteomics.com/technology/maldi-tof-mass-spectrometry.htm
