종양 관련 대식세포(Tumour-associated macrophages, TAMs)는 종양 미세 환경(Tumour microenvironment, TME)에 가장 많이 분포한 면역세포 중 하나로, 다양한 종양 관련 면역 반응의 조절자 역할을 담당합니다. 이전 글에서는 TAMs와 TME 구성 요소들과의 상호작용에 초점을 두어 설명하고, TAMs의 다양한 아형에 대해서 알아보았습니다. 이에 더하여, 본 글에서는 TAMs와 종양 세포 간의 직접적 연관성과 치료 타겟으로 활용할 수 있는 TAMs의 대사과정, 그리고 대식세포 기반 세포치료제 개발 현황에 대해 소개해보겠습니다.
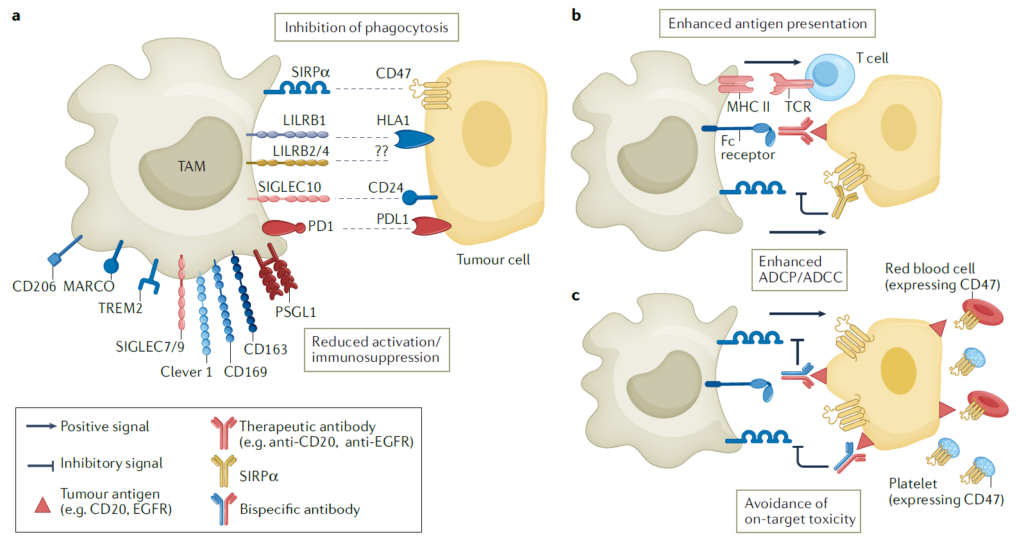
▣ 골수성 면역관문과 조절자 (Myeloid checkpoints and regulators)
골수성 단핵구의 기능은 직접 조절자들에 의해 결정됩니다. 조절자들은 골수성 면역관문 또는 스캐빈저 수용체(Scavenger receptor)로 분류할 수 있습니다. 이들은 면역 억제 환경을 조성함과 동시에 TAMs가 종양 조직으로 이동할 수 있게 돕지만, 종양 세포가 이 기전을 이용하여 면역 체계의 감시를 피하기도 합니다.
1) SIRPa and CD47
CD47은 일반 세포에서 흔히 발현되는, 식세포 작용의 회피 신호로 작동하는 단백질입니다. 일반적으로 포식세포나 호중구의 SIRPa와 결합할 경우 면역 반응을 회피하게 됩니다. 종양 세포들도 이를 발현하여 항암 면역 반응을 회피하므로, CD47-SIRPa 신호전달축을 방해할 경우, 종양 세포들에 대한 세포 사멸과 T세포의 활성화를 유도할 수 있습니다. 따라서, CD47을 타겟할 경우, T세포의 면역관문억제제와 병용 투여하였을 때 더 좋은 효과를 보입니다. 다만, CD47은 적혈구나 혈소판과 같은 일반세포에서도 광범위하게 발현되는 분자이므로, 이를 차단할 경우 빈혈, 혈소판 감소 등과 같은 부작용을 보일 수 있어 주의가 필요합니다. 이 부작용을 극복하기 위해 CD47 대신 SIRPa를 차단하거나, NK 세포와의 결합력이 약한 IgG4 항체를 사용하거나, 종양 세포 특이성을 높이기 위해 CD47과 동시에 종양 관련 항원을 인식하는 이중항체를 사용하는 플랫폼 등이 개발 중에 있습니다.
2) SIGLEC족
SIGLEC족은 막 단백질이며, 시알산(sialic acid)과 결합합니다. 이들은 세포질 말단에 티로신 기반 억제 수용체(ITIMs)를 포함하고 있으며, 이를 통해 면역 억제 신호를 전달하여 면역세포들의 기능을 조절합니다. 따라서 SIGLEC1이 대식세포, 종양에 발현되는 사례에서는 예후가 좋지 않습니다. 그러나 이를 이용하여, SIGLEC1을 발현하는 TAMs 제거 시, 종양의 크기가 감소하고 전이가 감소하였습니다. 같은 족의 단백질인 SIGLEC7과 9도 유사한 경향을 보이는 것으로 확인되었습니다.
3) LILRB족
종양 세포는 MHC 클래스1과 LILRB 단백질과의 상호작용을 통해 식세포 작용을 피하는 매커니즘을 이용하기도 합니다. LILRB1은 TAMs를 포함하여 면역세포에서 전반적으로 발현하고 있습니다. 해당 분자도 SIGLEC 단백질처럼 ITIM 모티프를 포함하므로, 면역 억제성 신호전달에 관여합니다. LILRB2+ 대식세포의 경우, LILRB2를 차단할 때 염증성 반응과 식세포 기능이 활성화됩니다. MK-4830은 LILRB2를 차단하도록 개발된 항체이며, 말기의 고형암에 대해서 임상 1상을 진행한 바 있습니다. 그 결과, GM-CSF나 TNF와 같은 염증성 사이토카인의 분비가 증가함과 동시에 세포독성 T세포의 항암 기능이 증가된 것을 관찰할 수 있었습니다. 같은 족의 LILRB4는 종양 내부로 침투한 TAMs에 가장 많이 발현되고 종양 관련 면역 반응을 강하게 억제하는 것으로 알려져 있습니다. LILRB4 또한, 차단 시 종양 침윤 T세포의 재활성화 또는 TAMs의 활성화된 표현형으로의 재분화를 유도할 수 있습니다.
4) 스캐빈저 수용체(Scavenger receptors)
스캐빈저 수용체는 TAMs에서 빈번하게 관찰되며, 이들은 염증반응의 스위치 역할을 하기에 치료 타겟의 가능성을 보이고 있습니다. 스캐빈저 수용체 중, CD163+ 대식세포와 종양 생장과의 연관성이 임상 결과 등에서 시사되고 있으며, 특히 췌장암과 흑색종에서 유의미한 단서들이 확인되었습니다. CD163+ 대식세포를 제거할 경우 항-PD1 치료법 내성 종양의 축소를 유도할 수 있었으며, 이 전략을 사용한다면 TME의 재구성과 T세포, 염증성 단핵구의 종양 침윤을 촉진할 수 있게 됩니다.
CD206은 병원체의 일부와 결합하는 수용체입니다. CD206이 리간드나 타겟 항체와 결합하는 경우, IL-10의 생산량 증가로 면역 억제 표현형이 유도됩니다. 이를 타겟한 펩타이드 약물인 RP-182는 CD206과 결합 후, 해당 수용체의 구조를 바꾸는 특성을 갖고 있습니다. 따라서 RP-182를 처리했을 때, CD206+ 대식세포를 감소시키거나, 항종양성 특성을 갖는 M1-유사 표현형으로 변화시켜 종양의 생장을 방해하는 효과를 갖습니다.
또 다른 스캐빈저 수용체인 MACRO 또한, TAMs에서 다수 발현하고 있습니다. 항-MACARO 항체를 사용한 결과, TAMs의 항암 면역 작용을 유도하고 TAMs를 염증성 표현형으로 재구성하는 결과를 얻었습니다. 또한 다른 표적들과 달리, 항-MACRO 항체를 사용할 경우 CD8+ T세포와 연관 작용이 아닌, NK세포의 세포 사멸 기능의 향상으로 이어졌습니다.
마지막으로, Clever1 수용체는 지질단백질 또는 탄수화물과 결합함으로써 세포 내로의 흡수를 매개하고, 흡수된 물질을 엔도좀으로 이동시켜 대식세포, T세포와 연관된 면역 기능 억제 신호를 조절합니다. 이 수용체가 차단될 경우, TAMs의 표현형이 억제성에서 염증 활성형으로 바뀌었으며, 자연스럽게 T세포의 활성화까지 이어지는 것을 확인할 수 있었습니다. 이러한 기전을 타겟하여 개발된 항-Clever1 항체인 FP-1305는 림프관에도 발현되는 Clever1의 특성에 따른 부작용을 감소시키기 위하여, Fcγ를 매개로 하는 세포 독성과 보체 연관 기능을 조절한 항체를 사용하였습니다.
5) TREM2 (Triggering receptor expressed on myeloid cells 2)
TREM2는 일부 조직의 대식세포에서 발현하며, 종양 내 TAMs에서 과발현 되는 것이 관찰되었습니다. TREM2+ 대식세포를 타겟, 억제할 경우 종양 생장을 저해할 수 있으며 항-PD1 치료법에 대한 반응성을 향상시킬 수 있습니다. 이를 타겟하는 단일클론항체인 PY314는 난치성 암인 말기 고형암에 대한 임상 1상을 진행중입니다.
6) PSGL1
PSGL1은 조혈세포 유래의 세포들에게서 발현되며, M2 분화 신호를 통해 발현이 유도되고 특히 TAMs가 높게 발현합니다. 항체를 이용해 PSGL1을 차단할 경우 M2 대식세포를 M1으로 재분화시키며, TME에서 억제된 면역 반응을 회복하여 항암 작용을 돕는다는 결과가 보고된 바 있습니다.
▣ 대식세포의 대사과정 타겟
다양한 아형으로의 분화과정을 거치는 대식세포는 기능 또는 표현형의 전환을 위해 아미노산, 지질, 철분 대사과정의 세세한 변화를 겪습니다. 이 대사과정을 타겟으로 하여, 종양환경에서의 대식세포의 반응성을 조절할 수 있습니다.
1) 후생유전학적 타겟
대식세포의 후생유전 단계를 조절할 경우, HDACs(Histone deacetylases)의 활성을 저해함으로써 변화를 줄 수 있습니다. HDACs의 차단제로는 TMA195, 테피노스탯(Tefinostat) 등이 있고, 이들은 말기 혈액암을 대상으로 한 임상에서 좋은 예후를 보여주었습니다.
2) 해당과정
종양 세포의 해당과정에서 부산물로 생성되는 젖산의 경우, 대식세포를 억제성의 M2-유사 표현형으로 분화시키므로, 해당과정을 차단하여 TAMs를 재분화시키는 전략을 사용할 수 있습니다. 그러나, 해당과정은 대식세포의 항암 관련 기능을 위해 필수적인 대사이기에, 해당과정 자체를 차단하는 것에 대한 의문이 제기되기도 합니다. 해당과정 차단제로 사용되는 메트포르민(metformin)은 이미 몇몇 암종의 임상 과정에서 연구되고 있습니다. 메트포르민은 TME를 재구성하여 TAMs의 밀도를 낮추고, 세포 사멸 작용은 촉진하는 것으로 보고되었습니다.
3) 글루타민 대사
억제성 M2-유사 TAMs의 경우 글루타민 소모가 증가하는 경향을 보이는데, 저분자 물질을 통해 이 대사를 감소시키거나 합성 효소를 저해할 경우 대식세포의 재분화를 촉진하여 종양의 생장을 감속시킬 수 있습니다.
4) 트립토판 대사
TAMs에서의 IDO-1 발현의 증가는 T세포의 활성화에 필수적 아미노산인 트립토판의 소모량을 증가시킵니다. 따라서 TAMs에 의한 트립토판의 소모는 T세포의 활성화에 악영향을 미치며, 면역 억제성 조절 T세포의 증가 현상을 불러일으킵니다. 이러한 현상을 막기 위해 IDO 억제제의 임상이 진행되고 있으며, 보고되는 결과 상 IDO의 완전한 억제 대신, TDO나 IDO2를 IDO1 대신 대체 발현하였을 때, 보다 긍정적 결과를 얻을 수 있는 것으로 확인되었습니다.
5) 지질 대사
TAMs의 대사 이상 중, 지질 대사 이상이 큰 비율을 차지합니다. TAMs에서의 지질 대사 이상 시, 옥시스테롤 수용체인 LXR이 전사인자를 통해 면역 억제성 신호전달을 유도합니다. 이를 기반으로 LXR를 타겟하는 전략들이 개발되었는데, 합성 LXR 작용제와 같은 물질을 사용할 경우 항염증 작용이 향상되었습니다. 지질 중 프로스타글란딘은 염증성 매개체이면서 동시에 종양 회피 기전의 조절자의 역할을 하기도 하는데, 종양에서 생성되는 PGE2의 경우 NK 세포의 활성화와 골수 세포의 염증 반응을 방해하며 이들의 표현형을 억제성으로 변화시킵니다. 이러한 현상을 차단하기 위해, 프로스타글란딘의 합성 효소인 COX2의 저해제 또는 PGE2의 수용체인 EP1/EP2의 길항제를 사용할 경우, 항암 인자들의 재활성화와 면역 관문 억제제의 효과를 향상시킬 수 있었습니다.
▣ 대식세포 치료제
TAMs는 체내를 순환하고 있는 단핵구에 의해 지속적으로 그 수가 유지되고 보충됩니다. 이와 달리, CAR-T세포는 혈액암 치료에는 효과적이지만 고형암 내부로는 침투하지 못하고 사멸하므로, T세포 기반 세포치료제는 고형암 치료라는 한계를 넘지 못하고 있습니다. 반면, 대식세포 기반 세포치료제는 종양 내 침투가 가능하므로 고형암 치료의 새로운 가능성을 열고 있습니다. 대식세포는 마치 트로이의 목마처럼, TME 내부로 사이토카인 또는 나노분자들을 운반할 수 있으며 수용체를 유전적으로 조작하여 특이적 수용체를 가진 포식세포로서 작용할 수도 있습니다. 이는 실험적으로 증명되어, 약물 탑재 나노입자로 채워진 단핵구가 혈관으로 주사되었을 때 나노입자 단독으로 주사되었을 때보다 종양 부위로의 전달이 훨씬 효과적이라는 결과를 얻었습니다.
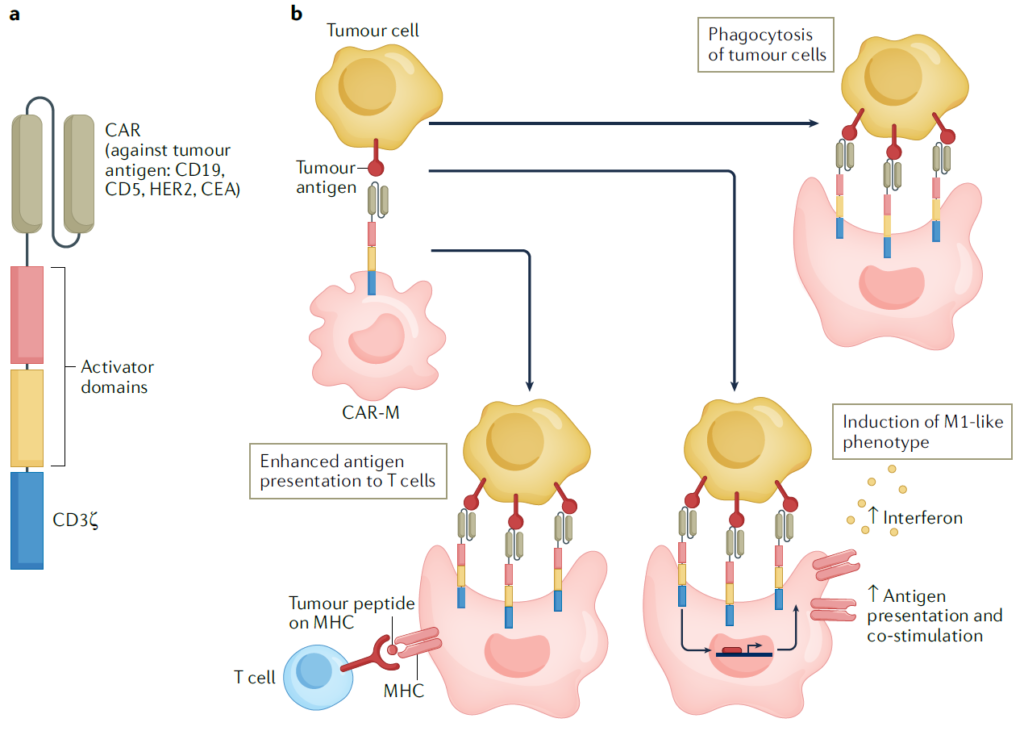
다만, 인간의 대식세포의 형질전환이 어렵다는 것이 장애물이 되어, 대식세포 기반 세포치료제의 개발이 어려움을 겪고 있지만 다양한 기술 플랫폼을 통해 이를 극복하기 위한 시도들이 계속되고 있습니다.
뿐만 아니라 종양 관련 인자들을 인식할 수 있는 수용체들을 발현하는 CAR-M세포가 개발되어 혈액암과 고형암을 모두 타겟하기도 합니다. CAR-M세포는 식세포 작용과 M1 표현형의 특성을 안정적으로 나타내며 원종양과 전이 종양 모두에서 효과를 나타내는 것을 확인하였습니다. CAR-M세포의 임상은 현재도 진행 중이며, 다양한 암종에 적용하기 위한 계획 중에 있습니다.
현재까지는 종양 세포와 직접적으로 상호작용하는 T세포 또는 NK세포를 이용한 항암 치료 접근법이 우세하였습니다. 그러나 해당 세포들만을 사용한 치료 전략으로는 고형암을 치료할 수 없기에, 최근에는 TME에 다수 분포하고 있는 대식세포를 이용한 치료법이 개발되고 있습니다. 대식세포가 갖고 있는 매력적인 특징은 다양한 표현형, 그리고 그 표현형 사이를 넘나들 수 있는 가소성입니다. 이는 신약 개발 측면에서 매우 흥미로운 특징이기도 하지만, 한편으로는 까다로운 특징이기도 합니다. 아직 밝혀지지 않은 기전들로 인해 대식세포를 표적으로 하는, 또는 대식세포 기반 세포치료제의 개발이 완성되지는 않았지만 최신 과학 기술의 발전을 통해 조금씩 설명되고 있는 대식세포의 대사과정, 분화 기전 등을 잘 이용한다면 기존 항암 치료 전략이 넘지 못했던 한계를 넘어, 혁신적인 항암 치료제가 될 것으로 기대하고 있습니다.
참고 : Mantovani A, Allavena P, Marchesi F, Garlanda C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 2022 Nov;21(11):799-820. doi: 10.1038/s41573-022-00520-5.
