면역항암치료제는 수많은 암환자들에게 완치라는 희망을 심어주고 있는 최신의 치료법입니다. 환자 자체면역체계를 이용하여 암을 치료하는 획기적인 접근법을 항암치료와 접목시키기 위해 많은 연구들이 진행중이며, 임상으로 이어지고 있습니다. 면역항암치료법의 여러 종류 중, 앞서 소개한 면역관문억제제의 뒤를 이어 T세포 이식 치료법(Adoptive T cell transfer therapy, ATC therapy)에 대해 알아보겠습니다.
ATC 치료법은 자기 또는 동종의 T세포를 암환자에게 이식하는 치료법으로서, 최근 수년동안 주목할만한 결과들을 보여왔습니다. 동종의 조혈모세포 이식을 통해 백혈병을 치료한 것이 임상에서의 첫 ATC 성공 사례가 되었으며, 이 결과는 T세포와 암세포의 면역반응으로 인해 이루어졌음이 연구를 통해 입증되었습니다.
본 글에서는 ATC 치료법을 두 가지로 나누어 설명하려고 합니다. 첫째로는 종양 침윤 림프구 (Tumour-infiltrating lymphocytes, TILs)의 이식법, 두번째로는 엔지니어링을 거친 T세포의 이식법입니다. 두 치료법에 대해서 함께 알아본 뒤, ATC 치료법이 현재 대면하고 있는 한계점에 대해서도 살펴보겠습니다.
종양 침윤 림프구(TIL)를 이용한 ATC
TIL을 이용한 ATC 치료법은 1980년대에 전이성 흑색종에 처음 적용되기 시작했습니다. 환자의 종양 생검을 통해 얻은 림프구는 IL-2와 함께 환자의 혈관으로 투여한 결과, 치료 효과를 보인 비율은 34%에 그쳤지만, 치료 효과가 평균 4개월 동안 지속되었고 일부 환자에게서는 완치라는 결과를 보였습니다. 더하여, 스크리닝을 통한 신생 항원 특이적 TIL의 선별 과정이 추가되었을 때 전이성 유방암에서 매우 좋은 예후를 보였습니다. 그러나, ATC 치료법을 통한 치료 효과를 보기 위해서는 항암 효과를 보이는 작용 T세포가 종양 내에 분포해야 하므로, 고형암을 포함한 다양한 암종에 적용하기에는 어려움이 존재해 적용 범위가 확대되지는 못했습니다.
ATC를 위한 T세포 엔지니어링
암 특이적 활성을 보일 수 있는 T세포의 대량 증식을 위한 노력은 TCR이 엔지니어링 된 림프구의 개발로 이어졌습니다. 일반적인 T세포들은 MHC에 의해 제시된 종양 항원에 대한 반응력이 떨어진다는 문제점이 있었고, 이는 암 표면의 항원을 직접 인식할 수 있는 합성 키메릭 항원 수용체(Chimeric antigen receptors, CARs)를 발현시킴으로써 해결될 수 있었습니다. 환자 또는 동종의 개체에게서 얻어진 T세포는 CAR 발현을 위한 유전적인 변형을 거쳐 대량 증식되고, 증식된 T세포를 다시 환자에게 이식하여 치료를 진행합니다.
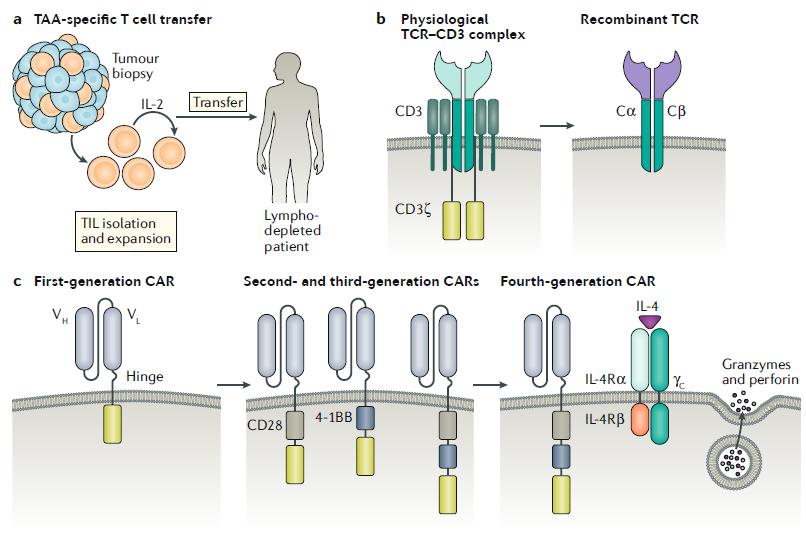
CAR는 항체의 항원 결합 도메인으로 구성되어 있으며 TCR의 신호전달 도메인, 다양한 동시자극 분자(co-stimulatory molecules) 등과 연결되어 있습니다. 이때 사용되는 세포 표면 신호전달 단백질의 특성상, 엔지니어링을 통해 다양한 조합의 세포외 도메인과 세포내 신호전달 도메인의 결합이 가능하므로 특정 암에 맞는 CAR를 합성하여 발현시킬 수 있습니다.
1세대 CAR-T세포 치료제는 CD3 ζ-사슬에만 의존하여 TCR 신호를 생성하는데, 이 디자인은 임상에서 T세포의 적은 증식과 사이토카인 생산 감소 문제로 인해 효과를 보이지 못했습니다. 이 단점을 보완한 2세대 CAR-T의 경우, CD28과 CD40 리간드의 도메인과 함께, T세포의 활성화를 유도할 수 있는 양성 조절자를 포함하도록 제작되어 1세대 보다 개선된 효과를 보였습니다.
CAR-T세포 치료제의 특징은 암 표면에 제시되는, T세포의 타겟 항원이 조직 특이적이어야 한다는 것입니다. 예를 들어 CD19(주로 B 세포가 발현)를 타겟으로 하는 CAR-T세포의 경우, B세포 림프종에 적용됩니다. 실제 임상에서 CD19 특이 2세대 CAR-T세포는 만성 림프구성 백혈병(Chronic lymphocytic leukaemia), B세포 급성 림프구성 백혈병(B cell acute lymphoblastic leukaemia), 미만성 거대 B세포 림프종(Diffuse large B cell lymphoma) 등에서 유의미한 결과를 남겨 FDA 승인으로 이어졌습니다. 해당 CAR-T세포의 임상 성공은 CD19가 특정 B세포 림프종에서 높은 발현률을 보이며 B세포 특이적 발현을 보인 덕분이었습니다. 그러나 CD19를 발현하지 않는 다른 암종에 대해서는, 여전히 연구가 진행되고 있습니다.
CAR-T 치료법은 고형암에서 제한적인 효과를 보였으며 이를 극복하기 위한 접근법이 꾸준히 시도되고 있습니다. 최근에 확인된 전암 유발자 B7-H3(또는 CD276으로도 알려짐)를 표적으로 하는 CAR-T세포는 다양한 소아 고형암 모델에서 유효한 결과를 보였습니다. 해당 CAR-T세포는 세포사멸 작용을 직접 수행할 뿐만 아니라 종양미세환경을 변화시켜 탈진 T세포를 회복시키기도 했습니다. Mucin16 (MUC16ecto)또한 또 다른 고형암 타겟 항원으로, 난소암을 대상으로 한 전임상 모델에서 좋은 예후를 보였습니다.
고형암의 특징인 종양미세환경에서의 T세포 탈진을 극복하기 위한 시도들 중, 종양미세환경에 풍부한 IL-4와 결합하여 T세포의 증식을 자극하는 키메릭 사이토카인 수용체(4αβ)의 발현으로 치료 효과를 강화하는 방법이 연구되고 있습니다. 이 접근법은 다양한 종양 관련 항원(tumour-associated antigens, TAAs)을 타겟으로 하는 CAR-T세포에서 유효하게 작용함이 확인되었습니다. 이 외에도 전사인자인 JUN의 과발현 등 다양한 방법들이 시도되고 있지만, 아직 고형암에 대한 CAR-T세포의 유효성은 검증이 부족한 단계입니다.
ATC 치료법의 부작용과 한계
CAR-T 치료법으로 인한 독성은 그 범위와 정도가 다양합니다. 가장 흔한 부작용은 사이토카인 방출 증후군(Cytokine release syndrome, CRS)과 신경 독성입니다. CRS는 CAR-T세포의 강력한 활성화와 증식으로 인해 발생하며 세포 이식 후 빠르게 나타납니다. 일반적으로는 증상이 경미하고 독감과 유사하지만 저혈압, 고열, 혈관 누출, 응고 장애 및 다기관 기능 장애와 같이 심각하게 나타나기도 합니다. 신경학적 증상으로는 뇌증후군이 발생하며, 섬망과 발작 또는 뇌부종 등으로 이어질 수 있습니다. 위와 같은 부작용의 완화를 위해서는 글루코코르티코이드(Glucocorticoid)가 일차적 치료제로 사용되고, 항 IL-6 항체인 Tocilizumab은 CRS의 이차 치료제로 사용됩니다.
특별히 CD19 특이적 CAR-T세포 치료의 부작용으로는 림프구 감소증(Lymphopenia)과 저감마글로불린혈증(Hypogammaglobulinaemia) 등이 있는데, 이는 기본 B 세포 면역 결핍 환자들이 받는 치료와 유사한 항체 정맥주사 요법으로 치료합니다. 이러한 부작용의 기작은 아직 명확하지 않으며, 추가 연구가 진행되고 있습니다.
ATC 치료법은 환자 개별 맞춤 치료 설계를 기반으로 하기에 막대한 비용을 지불해야 합니다. 면역관문억제제에 비해 CAR-T세포 치료를 받기 위한 비용은 수십배에 달하므로 환자들의 경제적 부담이 큰 편입니다. 또한 CAR-T세포를 생산을 위한 인증기관이 한정되어 있어 대량 공급이 어렵고, 해당 치료법을 적용할 수 있는 전문 의료 센터 역시 소수에 불과해 환자들의 치료 접근성이 낮습니다. 마지막으로, CAR-T세포 제조 과정의 가변성과 표준 생산 공정의 부재는 치료 결과의 일관성을 보장할 수 없다는 한계점을 갖습니다.
ATC 치료법은 종양세포의 특정 항원을 인식하는 T세포를 이용하므로, 종양세포를 특이적으로 사멸시켜 암을 치료할 수 있다는 장점을 갖고 있습니다. 다만, 특이적 항원이 부재한 암종과 고형암에서는 적용이 어렵다는 점과 함께, 낮은 치료접근성과 생산량과 공정의 불안정이라는 취약점으로 인해 치료 범위의 확대가 어려운 상황입니다. 이러한 한계점을 극복한다면 환자 개인에게 최적화된 항암치료법으로써 기존의 항암치료제보다 더 나은 대안적 치료법이 될 것으로 기대하고 있습니다.
출처 : Waldman AD, Fritz JM, Lenardo MJ. A guide to cancer immunotherapy: from T cell basic science to clinical practice. Nat Rev Immunol. 2020 Nov;20(11):651-668.
