이전의 3개의 글로, 면역항암치료제의 종류들과 치료 원리에 대해 다루어 보았습니다. 이번 글의 주제인 암백신을 마지막으로, 면역항암치료제에 대한 소개를 마치려고 합니다. 번외로, 면역항암치료제의 연구개발 방향성에 대해서도 함께 살펴보도록 하겠습니다.
암백신
암백신은 면역 체계의 반응을 유도하여 암으로부터 우리 몸을 보호하도록 합니다. 암백신은 예방, 그리고 치료적 접근법으로 나눌 수 있습니다.
예방적 암백신은 이미 우리가 알고 있는 백신의 개념과 유사한 접근법입니다. 주로 바이러스로 인해 발병하는 암을 예방하기 위해 투여됩니다. 대표적인 예로, Hepatitis B와 human papillomavirus에 대한 예방 암백신은 간암과 자궁암의 발생률을 낮추는데 중요한 역할을 해왔습니다. 반면, 치료적 암백신의 경우 면역 반응의 증폭을 통해 이미 암세포로 변화한 세포를 사멸시키는 목적으로 개발되었습니다. 치료 암백신의 초기 모델은 Mycobacterium bovis를 포함하는 백신으로, 본래 결핵의 예방을 위해 사용되었으나 추후 방광암의 초기 치료 백신으로 사용되었습니다.
종양관련항원(Tumor associated antigen, TAA)의 발견은 치료용 암백신 접근법의 포문을 열어주었습니다. 그러나 TAA는 종종 면역 체계에 의해 ‘자기’로 인식되어 적절한 면역 반응을 유도하는데 실패하였고, 따라서 악성종양에 특이적으로 발현되는 바이러스 항원이나 신생항원이 암백신의 적합한 타겟이 되었습니다.
1970년대의 백신은 자가조직 종양백신에 기반하여 개발되었습니다. 환자에게서 얻은 암세포를 보조제(adjuvant)나 바이러스와 함께 주입하여 TAA에 대한 복합적 반응을 일으킬 수 있도록 하였습니다. 더하여, 자가조직 종양백신을 면역관문억제제와 병용하였을 때 관찰되는 시너지효과가 악성흑색종에서 관찰되기도 하였습니다. 이 외에도 다양한 자가조직 암백신이 임상 2상과 3상을 진행 중입니다. 그러나, 암백신의 이러한 접근법은 특정 암종에 대한 환자 유래 암세포를 얻어내는 것이 어렵다는 한계를 갖고 있습니다. 이 점을 극복하기 위해 종양 유래 DNA에 대한 NGS기술의 발전을 기반으로 한, 각 개인에게 맞춰진 재조합 암백신이 등장하였습니다.
개인 맞춤형 재조합 암백신
종양 유래 신생항원에 대한 반응을 유도하는 백신의 경우 TAA를 기반으로 작동하는 암백신보다 강력한 면역 반응을 이끌어낼 수 있을 것으로 기대하고 있습니다. 또한 해당 백신으로 인해 자극되는 T 세포는 부정적 선택과정 (negative selection)을 거치지 않은 T세포를 대상으로 하므로, 자가면역반응으로 인한 독성이 없을 것으로 예측되고 있습니다. 또한 종양 유래 DNA에 대한 연구가 진행됨에 따라, 이에 대한 이해도가 높아졌고 이와 같은 요인들은 신생항원을 타겟하는 개인 맞춤형 암백신의 임상적 가능성을 보여주었습니다.
그러나, 종양의 특성 상 돌연변이의 발생률이 높고, 작은 비율의 신생항원만이 환자에게서 유의미한 반응을 유도할 수 있습니다. 때문에, 적절한 신생항원을 찾기 위해 많은 시간과 노력이 필요합니다. 이 과정의 효율성 증대를 위해, NGS (next generation sequencing)기술에 기반하여 유의미한 신생항원을 발견하기 위한 시도들이 있었습니다. 이 연구에서, 50개의 신생항원 중 16개의 유의미한 신생항원을 추렸고, 이들 중 다수의 신생항원들은 CD8+ T 세포 보다 CD4+ T세포에서 사이토카인 반응을 더 잘 유도하였으며, 이는 신생항원들이 MHC2 class를 통해 선택된다는 것을 시사합니다.
실제 치료에 사용될 개인 맞춤형 백신을 설계하고 생산하기 위해서는, 컴퓨터 기반 알고리즘을 통해 어떠한 종양 유래 펩타이드가 환자의 MHC에 적합한 TAA 또는 종양신생항원을 형성할 것인가를 확인해야 합니다. 신생항원의 반응성이 확인된다면, 해당 항원에 기반하여 백신을 제작하기 위해 선택할 수 있는 다양한 전략들이 존재합니다. 합성 펩타이드, mRNA, 바이러스 플라스미드 또는 DNA 플라스미드, 그리고 항원 탑재 수지상세포 등을 이용할 수 있는데, 각각의 방법들이 면역원성에 미치는 영향은 직접적으로 비교된 바가 없습니다.
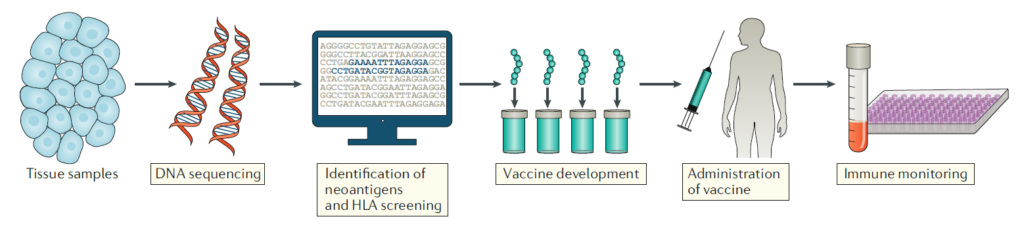
암백신의 한계
암백신 연구는 촉망받는 분야이지만, 여전히 넘어야 할 한계점이 존재합니다. 각 개별 종양은 수천개의 체세포 돌연변이를 가질 수 있으며, 어떤 신생항원이 강력한 항암 효과를 낼 수 있을지 예측하는 것은 매우 어렵기 때문입니다. 그러나, 돌연변이 mRNA의 발현량을 측정하거나 펩타이드-MHC 결합을 소프트웨어 데이터베이스를 통해 예측하는 등의 방법들을 사용하였을 때, 임상에서 놀라운 효과를 보여주고 있습니다. 이러한 성공적인 임상 사례들은 MHC class 1 특이적 신생항원을 타겟하였을 때 나타났고, MHC class 2에 대한 타겟은 아직도 난항을 겪고 있습니다.
동시에 고민해봐야 하는 것은 개인맞춤형 백신을 개발할 때 소요되는 시간과 비용의 문제입니다. 현재로선, 이러한 백신을 개발하기 위해 약 4개월의 시간이 소요되기에, 진행이 빠른 전이성 암의 경우 개발 시간을 단축하는 것이 중요한 문제로 부상하고 있습니다.
또한 암백신에 대한 임상시험은 아직 초기 단계에서 진행중이기에, 확실한 결론을 얻기 위해서는 추후 진행될 임상의 결과에 집중해야 할 필요성이 있습니다.
그럼에도 불구하고, 암백신은 환자들을 같은 암종으로 묶어 치료를 진행하는 것이 아닌, 환자 개인의 질병을 하나의 독립적 질환으로 인식하여 ‘1환자 1질환(single patient and single disease)’ 치료법을 컨설팅하는 시대를 연다는 점에서 주목할 만한 접근법으로 볼 수 있습니다. 추후 진행될 연구와 기술 발전 또한 현재 암백신이 대면하고 있는 한계점을 해결할 수 있을 것입니다.
면역항암치료요법의 향후 연구 방향
암에서의 유전자 변형 빈도가 높다는 점, 그리고 그 종류가 무한하다는 점은 암의 매커니즘에 복잡성을 더해 치료에 난항을 겪게 합니다. 그러나 면역 항암 치료 분야의 빠른 발전으로, 현재의 면역치료법에 여러 변형을 더해 암의 복잡성을 뛰어넘을 수 있는 치료법들이 제시되고 있습니다.
그 첫번째 대안으로, 병용요법이 연구되고 있습니다. 면역관문억제제를 단독으로 사용했을 때 임상에서 보여주는 성공적 사례에 기반하여, 서로 다른 기전으로 작용하는 치료제들을 병용하여 투여하였을 때 여러 암종에서 치료에 성공한 사례가 보고되고 있습니다. 그 예로 ipilimumab과 nivolumab의 병용요법은 전이성 흑색종, 신장암에서 효과를 보여 FDA의 승인을 받은 바 있습니다.
항-CTLA4 치료제와 항-PD1 치료제가 서로 시너지 효과를 보이는 것은, 기전적으로 CTLA4와 PD1이 상호보완적으로 작용하기 때문입니다. CD80과 PDL1의 이합체화로 매개되는 CTLA4와 PD1 신호전달체계의 교차는 병용요법이 성공적으로 암을 치료하는 메커니즘을 설명하는 근거가 됩니다. 이러한 점에서 병용요법은 매우 합리적인 치료적 대안이 될 수 있으나, 면역관문억제제의 병용요법은 약물 독성의 위험을 증가시키기도 합니다.
두 개의 치료제 뿐만 아니라, 방사선 치료와 면역관문억제제의 병용요법 또한 난치성 암의 새로운 접근법입니다. 방사선 치료를 단독으로 진행하였을 때의 면역조절 효과는 양날의 검과 같습니다. 메커니즘 상, 방사선 치료는 종양 세포의 PD1 발현을 유도함으로써 면역 반응을 억제함과 동시에, 신생항원을 노출시킴으로써 항암 반응을 보이는 T세포의 다양성을 증가시킵니다. 따라서 전임상 결과를 토대로 하였을 때, 방사선 치료와의 PD1 억제제의 병용 효과는 상당히 매력적인 치료법이 될 수 있습니다. 이 치료법은 주로 전이성 암을 앓고 있는 환자들에게 적용될 때 좋은 효과를 보일 것으로 기대하고 있습니다.
기존에 존재하던 치료법과 조합하는 방식의 병용 요법과 달리, 새로운 항암 타겟을 찾으려는 연구들도 진행되고 있습니다. T세포 활성화의 새로운 타겟인 LAG3(Lymphocyte activation gene 3), TIM3(T cell immunoglobulin 3), VISTA(V-domain immunoglobulin suppressor of T cell activation), B7-H3, TIGIT(T cell immunoreceptor with immunoglobulin and immunoreceptor tyrosine-based inhibitory motif domains) 등이 그 대상이 됩니다. 일례로, LAG3의 경우 T 세포의 활성화를 막는 역할을 하며, T 세포 탈진의 마커로서 사용하기도 합니다. LAG3를 통한 신호전달을 막기 위해 LAG3-Ig fusion protein 또는 단클론 항체가 사용되었으며 그 결과, 신장암과 췌장암 환자들에게서 단일 요법으로는 효능을 보이지 못했지만 paclitaxel과 병용하여 유방암에 적용되었을 때는 50%의 환자에게서 치료능을 보이는 것을 확인하였습니다.
면역관문 억제 기전 외에도, T 세포의 공동자극 수용체인 ICOS(Inducible co-stimulator) 등을 이용하여 현존하는 면역항암치료의 효능을 증폭시킬 수 있는 타겟들이 발견되고 있고, 이를 적용한 치료법으로 전임상 또는 초기 임상 단계가 진행되고 있습니다.
결론
T 세포를 타겟으로 하여 암을 치료하려는 시도는 꾸준히 발전되어 왔습니다. 이 치료법을 적용하기 위해 기초과학에서 임상의학으로의 전환에 오랜 시간이 걸리긴 했지만, 결국 면역 체계를 조절하여 암을 치료하기에 이르렀습니다. 향후 연구들은 T 세포 뿐만이 아닌 항원제시세포 (Antigen presenting cell, APC)와 NK 세포 또한 조절하여 치료하는 접근법으로 진행될 것으로 보입니다.
난치성 종양에서는 T세포 이식 치료법과 암백신이 현재까지 가장 효과가 좋았던 화학요법의 치료 범위를 넘어서고 있습니다. 비록 면역반응과 관련된 부작용들이 여전히 존재하지만, 면역반응을 이용한 혁신적인 치료법은 기존의 화학요법보다 더 원만하게 적용될 수 있을 것으로 기대하고 있습니다. 성공적인 치료 사례들을 힘입어, 면역항암치료법은 계속해서 연구개발 되고, 새로운 타겟들을 찾아 더욱 발전될 것입니다.
Reference : Waldman AD, Fritz JM, Lenardo MJ. A guide to cancer immunotherapy: from T cell basic science to clinical practice. Nat Rev Immunol. 2020 Nov;20(11):651-668. doi: 10.1038/s41577-020-0306-5.
