종양미세환경(Tumor microenvironment, TME)이 항암치료에 미치는 영향에 대한 연구 결과들이 밝혀지면서, 종양 자체를 목표로 하는 것이 아닌, 종양미세환경에 변화를 주어 효과적인 항암치료를 가능하게 하는 접근법이 부상하고 있습니다. 이번 본문에서는 종양미세환경의 구성 요소 중 하나인, 대식세포와 항암치료와의 상관관계에 대해서 알아보려고 합니다.
종양미세환경은 종양의 발생과 성장에 필수적인 환경 조건으로서, 염증성 세포와 그 매개체들이 핵심 구성 요소입니다. 종양 연관 대식세포(Tumour-associated macrophages, TAMs)는 염증과 종양 사이의 연결고리가 되어줍니다. 염증성 종양미세환경이 형성되는 원인은 크게 유전적 요인, 또는 조직 외부 환경의 염증성 요인으로 나누어 볼 수 있습니다. 그러나, 종양 조직의 종류마다 그 요인은 더 다양해지거나, 달라질 수 있습니다. 그럼에도 불구하고, 단핵구(Monocytes) 또는 대식세포(Macrophage) 등과 같은 골수성 단핵구의 종양 침윤은 유래와 위치에 상관없이 모든 종양의 공통적인 특징입니다.
TAMs는 환경 조건에 따라 가소성을 보이는 특징이 있으며, 따라서 항암 치료적 관점에서는 양날의 검입니다. 항암 친화적으로 기능하는 경우, TAMs는 종양 세포 사멸, 항체 의존적 세포 독성 또는 식세포 작용을 보이기도 하며, 혈관 신생을 막거나 종양 괴사를 유도하고 백혈구를 활성화하여 종양에 대한 저항 반응을 이끌어 냅니다. 반대로, 이미 종양이 발생하여 안정화된 단계에서는 다양한 매커니즘을 통해 종양의 진행과 전이를 유발하기도 합니다.
오늘의 본문에서는 TAMs의 역할과 종류에 집중하여, 이들이 기존의 항암 치료법에 미치는 영향에 대해 살펴보겠습니다.
◈ TAMs의 다양성
TAMs는 주로 골수성 단핵구의 전구 세포에서 분화됩니다. 그러나 항상성 조건에서는 배아 전구체에서 유래된 조직 상주 대식세포(Tissue-resident macrophages, TRMs)도 TAMs의 수를 유지시키는데 관여하는 것으로 보이고 있습니다.
다양한 암종에서 공통적으로 발견되는 TAMs의 역할은 면역 억제 기전을 통해 종양 신생 과정과 발달에 영향을 미치는 것입니다. 췌장암에서는 TRMs가 국지적으로 증가하고 섬유조직화에 기여하는 듯한 전사체 프로파일을 보였으며, 쥐의 자궁암 모델에서는 복막의 대식세포가 암줄기세포를 보존하여 전이를 촉진하는 경향을 보이기도 했습니다. 뇌-혈관장벽(Blood-brain barrier, BBB)로 구분되어 있는 뇌의 경우, 뇌 특이적 대식세포인 미세아교세포(microglia)가 뇌종양세포의 증식과 전이를 촉진하였으며, 이는 mTOR 신호 전달을 통한 면역 억제 기전을 통해 이루어졌습니다. 이 과정에서 발생하는 후생유전학적 변화로 인해, 종양미세환경으로 TAMs의 모집이 활성화되고 주변 조직을 종양 친화적 환경으로 변화시킨다는 보고가 있습니다.
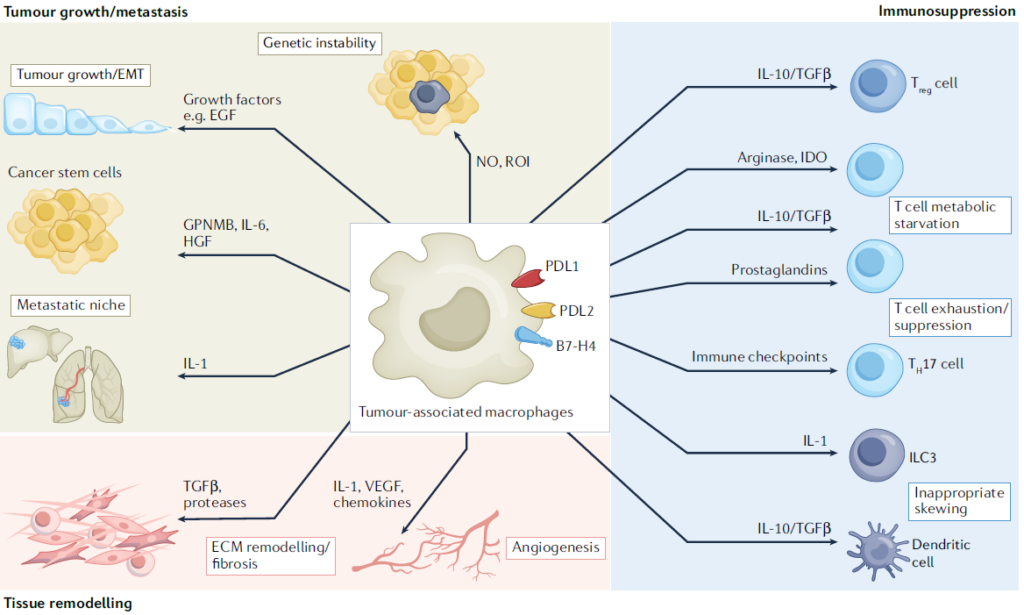
TAMs를 유전적으로 접근해보면, TRMs가 TAMs의 대부분을 구성하고 있으며 암의 신생 단계에 관여하여 면역 체계로부터 종양세포를 보호하는 것으로 보입니다. 이후, 종양의 진행과 성장 과정에서는 골수성 단핵구 유래의 대식세포가 종양 위치로 모집되어 종양의 성장을 가속화합니다. 이러한 결과는 쥐의 뇌종양 모델 등에서 확인되었지만, 반대로 폐암 모델에서는 TRMs와 골수성 단핵구 유래의 대식세포가 함께 조절 T 세포(Regulatory T cell, Treg)의 수를 유지함으로써 종양 초기의 면역 억제적 TME를 형성한다는 결과가 보고되었습니다. 이렇듯 대식세포는 종양미세환경에서 유동적으로 작용하며, 조직특이성에 따라 다른 역할을 수행하지만 대부분의 경우 종양의 생장에 긍정적으로 관여하는 것으로 알려져 있습니다.
위와 같이, TAMs를 유래에 따라 크게 두 가지의 군집으로 분류할 수 있지만, 단일 세포 RNA 시퀀싱 등을 사용하면 더욱 세분화된 하위 집단 정보를 수집할 수 있고, 이를 통해 치료의 타겟을 구체화할 수 있게 됩니다. TAMs는 일반적으로 M2와 유사 표현형을 갖습니다. 다양한 면역세포들이 분비하는 TGF-b, CSF1, CCL2, IL-4, IL-1 등의 신호를 통해 종양 부위로 모집되거나 M2 유사 표현형을 갖도록 분화하게 되며, 이 외에도 히스타민 또는 장내 미생물 유래 물질을 통해 종양 촉진 편향을 갖게 됩니다. 그러나 앞서 언급된 것처럼 단일 세포에 대한 분석을 시행했을 때, 다양한 세부 표현형과 전사체, 세포 표면 단백질을 갖는 만큼 약물이나 치료법에 대한 서로 다른 민감도를 갖습니다. 따라서, 단일 세포 분석법을 통해 조직별 암종에 존재하는 다양한 TAMs에 대한 데이터를 기반으로 할 때, 혁신적인 치료적 접근법의 개발과 예방적 차원의 진단 마커를 발견할 수 있습니다.
이와 같은 TAMs의 가소성이라는 특성과 함께, TAMs의 기능적 변화를 일으키는 원인에 대한 정확한 이해가 부족하다는 것을 고려했을 때, 섣불리 TAMs를 치료 타겟으로 설정하기에는 어려움이 있습니다. 그러나 TAMs의 종양 침윤이 갖는 부정적 예후에 대한 연구가 진척되면서, 대식세포를 표적으로 하는 치료 전략에 대한 임상 평가도 점차 진행되고 있습니다.
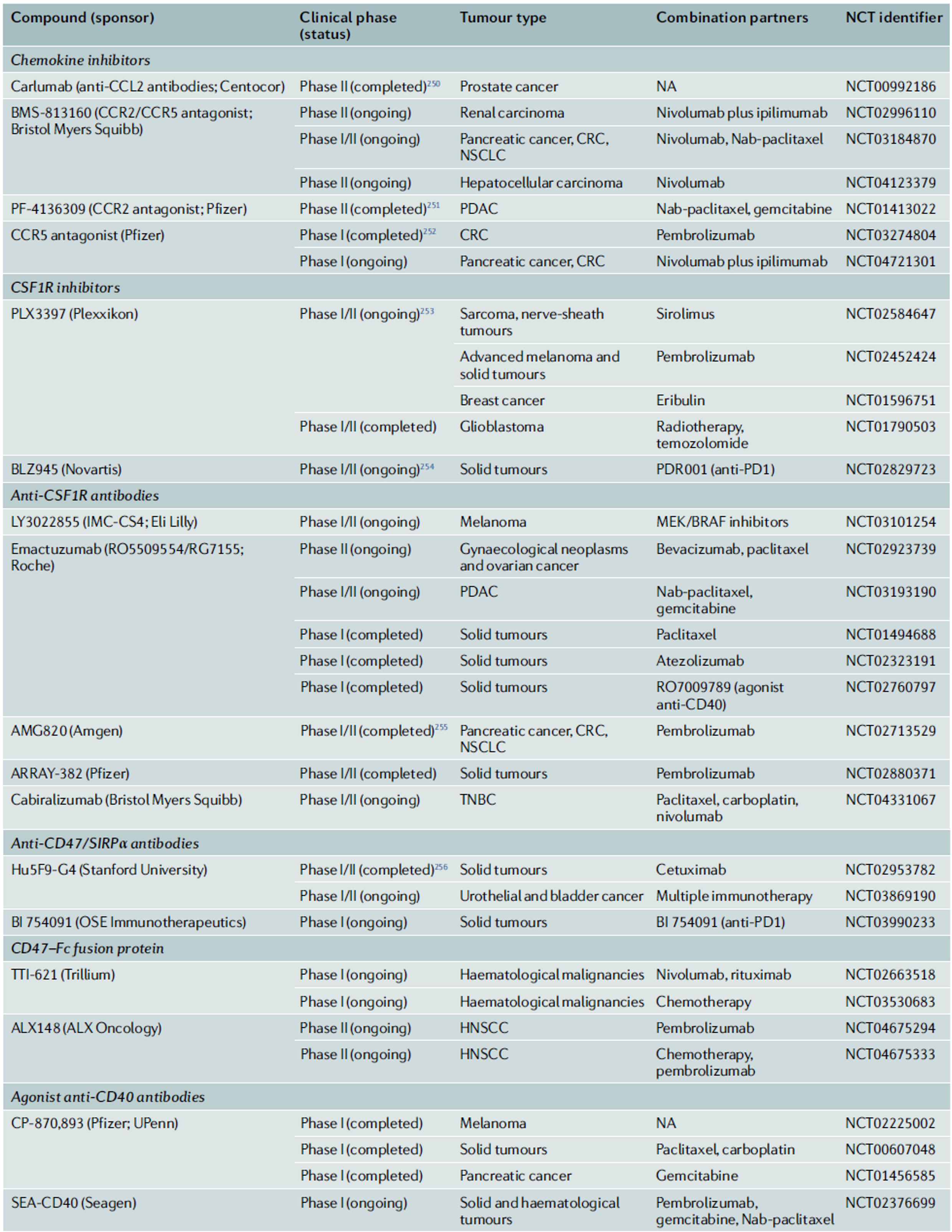
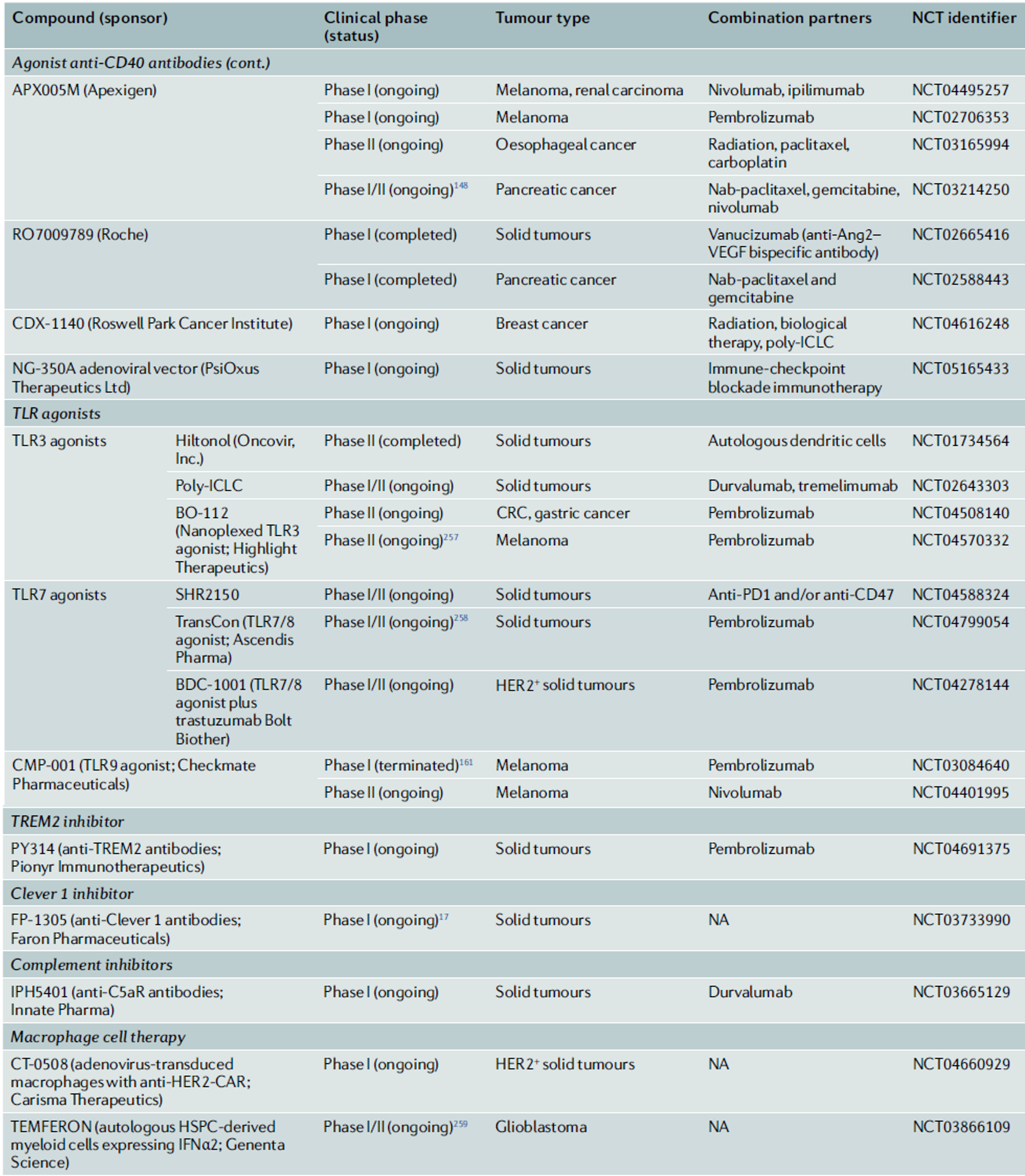
◈ 전통적 항암 치료법에서의 TAMs
현재까지 일반적으로 사용되던 항암치료법으로는 화학요법, 항체치료법, 호르몬치료법 등이 있습니다. 해당 치료법들의 작용 기전을 자세히 들여다보면, 핵심적인 역할을 하고 있는 대식세포를 발견할 수 있습니다.
화학항암제인 독소루비신(Doxorubicin)은 종양 항원과 보조 분자들의 분비를 유도함으로써, 대식세포가 종양세포의 면역원성 세포 사멸(Immunogenic cell death, ICD)를 일으킬 수 있도록 합니다. 해양 유기체에서 추출된 트라벡테딘(Travectedin)과, 유사체인 루비넥테딘(Lurbinectedin)은 비소세포성 폐암의 치료제로서 환자의 단핵구와 TAMs만을 선택적으로 제거하여 항암 치료가 잘 이루어질 수 있도록 돕습니다.
그러나 반대로, 오히려 TAMs가 화학항암제의 치료능을 제한하기도 합니다. 뇌종양에 존재하는 미세아교세포의 경우, 종양 내에서 STAT3-MYC 경로를 활성화하여 테모졸로마이드(Temozolomide)에 대한 내성을 유발합니다. 이로 인한 내성 발생을 막기 위해 대식세포의 분화와 학습에 관여하는 인자인 CSF1을 막을 수 있는 항-CSF1, 항-CSF1R 항체를 병용으로 투여할 경우 실제 임상에서 화학요법과 상승작용을 보이는 것으로 나타났습니다.
TAMs는 항체치료제의 효능에도 영향을 미칩니다. FcrR를 발현하는 TAMs의 경우 종양 세포의 사멸을 돕는데, 이러한 기전으로 작용하는 항체치료제로는 리툭시맙(Rituximab, 항-CD20), 트라스트주맙(Trastuzumab, 항-HER2), 세툭시맙(Cetuximab, 항-EGFR), 다라투무맙(Daratumumab, 항-CD38) 등이 있습니다. 종양세포의 사멸에 직접적으로 기여하지 않더라도, 혈관 생성을 억제하는 기전으로서 항체치료제를 사용하기도 하는데, 이 때 사용되는 VEGF 차단제는 혈관 신생을 유도하는 VEGF를 분비하는 TAM의 표현형을 재구성하여 혈관 신생을 억제해 종양의 생장을 막습니다.
호르몬 기반 항암치료법 또한 TAMs가 조절하는 염증성 신호전달체계의 영향을 받습니다. IL-1, IL-6와 같은 염증성 사이토카인들은 암세포의 에스트로겐 수용체를 통한 신호체계를 활성화하는데, 이는 종양의 성장과 염증으로 이어집니다. 종양에 발현되는 호르몬 수용체가 아닌, TAMs에 직접적으로 발현되는 안드로겐 수용체의 경우 TAMs가 종양 생장에 친화적인 표현형으로 전환되는 데에 기여합니다. 따라서 항-안드로겐 치료제는 종양에서의 TAM의 수를 감소시키고, TAMs에서 분비되는 IL-23을 차단할 경우 안드로겐 차단 치료법에 대한 반응성을 향상시킵니다.
기존에 사용되는 화학치료법, 혈관 생성 억제 치료법, 호르몬 치료법에서도, TAMs가 직접적인 타겟이 아니더라도 치료 효과에 지대한 영향을 미치고 있음을 확인하였습니다. TAMs의 역할은 복합적이고 양면적이어서 종양의 생성에 증폭자, 또는 억제자로서 모두 작용할 수 있습니다. 하지만 TAMs의 특성을 실제 치료에 활용하려면, 표현형의 전환이나 분화 과정에 대한 명확한 이해가 수반되어야 합니다.
◈ 면역관문 억제제를 이용한 치료법에서의 TAMs
T세포를 매개로 하는 면역 반응의 기전이 밝혀지면서, 면역관문 억제제(Immune-checkpoint blockade, ICB)를 이용한 면역 치료법의 기반이 마련되었습니다. 면역 억제 기전의 주요 조절자인 TAMs는 ICB의 예후를 결정하는 중요한 요인이며, 치료법에 대한 내성을 결정짓는 외인적 요소이기도 합니다. 이들은 면역 관문 억제 분자인 PDL1, PDL2, CD80(B7-1), CD86(B7-2), PVR 등을 발현하기 때문입니다. TAMs가 발현하는 PD1은 종양 세포에 대한 식세포 작용과 음의 상관관계를 갖습니다. 또한 흥미롭게도, TAMs는 T세포, NK세포가 발현하는 부정적 조절자와 상호작용할 수 있는 수용체를 발현하는 것으로도 알려져 있습니다. 그 예로, VISTA는 TAMs에서 발현되어 PSGL1과 상호작용함으로써 T세포의 면역관문 억제제로서 기능합니다. 이 때문에 항-VISTA 단일클론 항체를 사용하는 경우 TAMs의 전사체와 기능 면에서 변화를 이끌어 내어 항원 제시, 기능 활성화, 면역 세포 이동 등을 증가시킬 수 있습니다.
ICB 치료에서의 TAMs의 역할은 다양한 조직의 암종에서 확인되었습니다. 예를 들어, 삼중음성 유방암에서 호중구와 TAMs가 ICB에 대한 내성을 결정하고, 간암의 TAMs는 T세포 매개 면역요법에 대한 반응에 부정적 조절자로 기여하는 것으로 알려졌습니다. 흉강과 늑강의 경우 면역 억제 환경에서 종양이 진행되는 대표적인 예인데, 환자의 체강에 존재하는 TIM4+ 대식세포는 CD8+ T세포의 반응을 억제하여 ICB의 효과를 방어합니다. 따라서 TAMs를 제거하는 경우, 백신이나 면역관문 억제제의 다양한 면역 치료 전략의 내성을 낮추고 치료 효과를 상승시킨다는 연구 결과 또한 보고되었습니다.
이번 본문에서는 종양미세환경에 존재하는 대식세포의 역할과, 이들이 기존의 항암치료법의 예후에 미치는 영향에 대해서 알아보았습니다. 다음 글에서는 대식세포를 직접적으로 타겟하는 치료적 접근법과, 이 때 활용할 수 있는 대식세포의 작용 기전 등에 대해서 정리해보겠습니다.
참고 : Mantovani A, Allavena P, Marchesi F, Garlanda C. Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov. 2022 Nov;21(11):799-820. doi: 10.1038/s41573-022-00520-5.
