T세포의 세포사멸능력은 암과 싸우기 위한 면역체계의 핵심으로 주목받아왔습니다. T세포에 대한 연구가 계속되면서, 암 치료의 새로운 전략인 면역관문억제제(Immune checkpoint blockade), 차용세포요법(Adoptive cellular therapy), 암백신(Cancer vaccinology)등이 등장했습니다. 시리즈로 이어질 본문에서는 이러한 면역항암치료제의 원리와 종류에 대해서 알아보겠습니다.
면역항암치료제의 탄생과 발전
면역 반응을 이용하여 암을 치료하려는 노력은 19세기에서부터 시작되었습니다. 빌헬름 부시와 프리드리히 펠레이센(Wihelm Busch and Friedrich Fehleisen)이 면역 시스템과 암 사이의 역학관계를 처음으로 발견했는데, 이들은 박테리아로 인해 발생하는 피부 감염과 동시에 종양이 작아지는 것을 관찰하였습니다.

이후 면역항암치료의 아버지라고 불리는 윌리엄 콜리(William Coley)가 해당 피부병이 육종의 치료를 돕는다는 것을 증명하였습니다. 이것을 바탕으로 콜리는 면역반응의 활성화를 돕기 위해 균추출물을 사용하여 항암치료를 시행하였는데, 콜리 톡신(Coley’s toxin)이라고 불리는 이 물질은 다양한 암종에서의 효과를 보였습니다. 그러나 콜리 톡신의 명확하지 않은 치료 원리와 방사선치료, 화학 요법의 등장으로 이는 표준 항암 치료로서 인정받지 못하였습니다.
20세기에 들어서, 면역항암치료제는 다시 주목받기 시작하였습니다. 다수의 과학자들은 종양세포에 대한 면역반응 연구를 통해, 이식 거부반응과 같이 체내 면역이 암에 대항한다는 가설을 입증하였습니다. 면역세포 중에서도 T세포가 암에 미치는 영향력이 명백하게 밝혀지면서, 면역항암치료제의 과학적 근거가 마련되었습니다.
현재 면역항암치료법은 암을 정복하여 환자의 생존율을 높이는 혁신적인 전략으로 떠오르고 있습니다. 병용요법과 새로운 약물 타겟에 대한 연구가 진행되며 면역항암치료의 성과는 꾸준히 확장되고 있습니다.
본 시리즈에서는 면역항암치료의 대표적인 3가지 전략인 면역관문억제제, 차용세포요법, 암백신에 대해서 설명하려고 합니다. 그리고 현재 새롭게 연구되고 있는 타겟들과 접근법들에 대해서도 소개하겠습니다. 그 전에, 오늘 본문에서는 이 모든 전략들의 기반이 되는 T세포에 대해서 먼저 알아보겠습니다.
T세포의 기능과 생애
적응면역(Adaptive immunity)의 핵심에는 T세포와 B세포, 두 세포가 있습니다. B세포는 체내를 순환하는 항원을 인지하고 이에 특이적인 항체를 분비함으로써 면역반응을 유발합니다. 이와는 반대로, T세포는 항원제시세포 (Antigen presenting cell, APC)내에서 분해되어 MHC를 통해 세포 표면에 제시된 펩타이드 형태의 항원을 인지하여 반응합니다.
T세포는 그 기능이 작동하는 기전에 따라 크게 두 종류로 나뉘는데, 각각은 세포 표면의 CD4 또는 CD8의 발현에 따라 구분할 수 있습니다. CD4+ T세포는 MHCⅡ에 제시된 항원을 발견하고 면역조절능을 가진 사이토카인(Cytokine)을 생성하여 적응 면역 반응을 조절합니다. 반면, CD8+ T세포는 MHCⅠ에 제시된 항원을 인지하여 세포독성반응을 일으켜 감염세포 또는 암세포를 직접 사멸시키는 역할을 합니다.
이들이 공통적으로 갖고 있는 T세포 수용체(T cell receptor, TCR)는 클론 특이적인 세포 표면의 단백질 복합체로, T세포의 성숙과 활성화에 핵심적인 요소입니다. TCR은 다양한 당단백류와 신호전달 단백질들로 이루어져 있는데, 이 단백질들의 재배열을 통해 클론 특이적인 T세포가 형성되며 양성 또는 음성 흉선선택(thymic selection) 과정을 거쳐 외부 항원에 대한 선택적 반응을 일으킬 수 있는 T세포로 성장합니다.
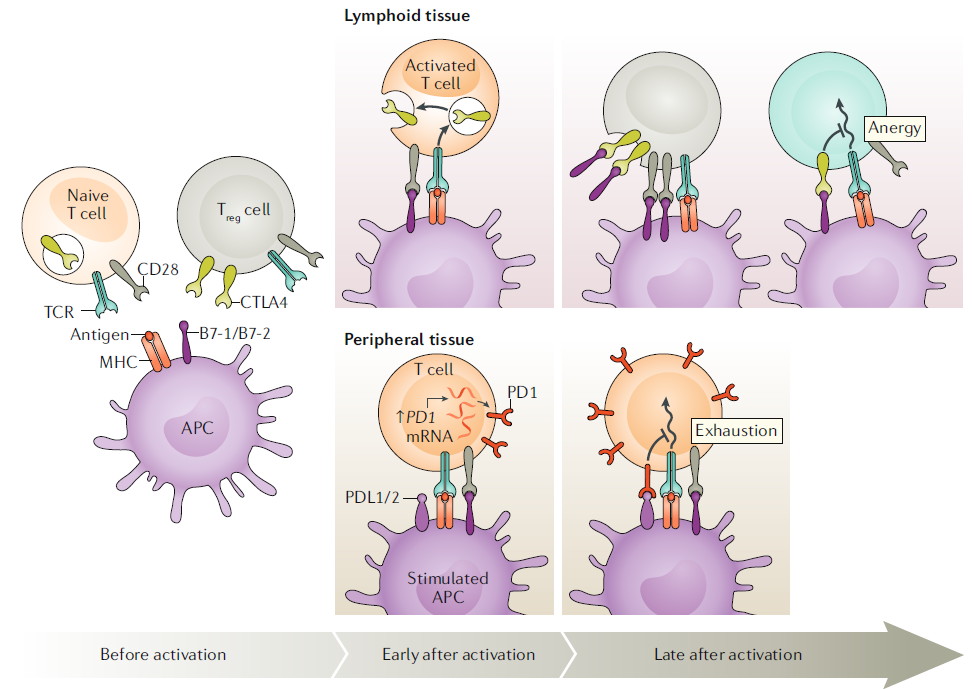
TCR을 통한 항원 자극은 T세포의 기능과 증식에 필수적입니다. 그 외의 보조 자극을 통해서는 세포 내 신호전달에 필요한 인산화가 이루어지며, 이러한 자극의 수집은 CD28과 같은 표면 수용체에 의해서 발생합니다. TCR과 CD28, 두 수용체를 통한 신호전달이 동시에 발생할 때 T세포는 정상적인 활성화와 증식이 가능합니다. CD28 수용체에 결합하는 B7-1, B7-2는 APC에 발현되며, APC가 Toll유사수용체(Toll like receptor, TLR)와 같은 항원 센서에 의한 자극을 받았을 때 증가 발현됩니다.
반면, APC의 B7과 결합하는 T세포의 cytotoxic T lymphocyte-associated protein 4(CTLA4), programmed cell death 1(PD1)과 같은 단백질의 발현은 면역반응이 진행되면서 유도되며, T세포의 과잉 활성화를 방지하기 위한 ‘면역관문(Immune checkpoint)’으로서 작용합니다. TCR을 통해 전달된 신호는 CD3를 통하여 세포 내의 lymphocyte-specific protein kinase(LCK)를 통해 하위 신호전달체계로 이어지는데, 이 과정은 평소에는 표면 단백질인 CD45로 억제되어 있지만 T세포 자극 시 억제를 해제하여 하위 신호전달과정이 진행될 수 있도록 합니다.
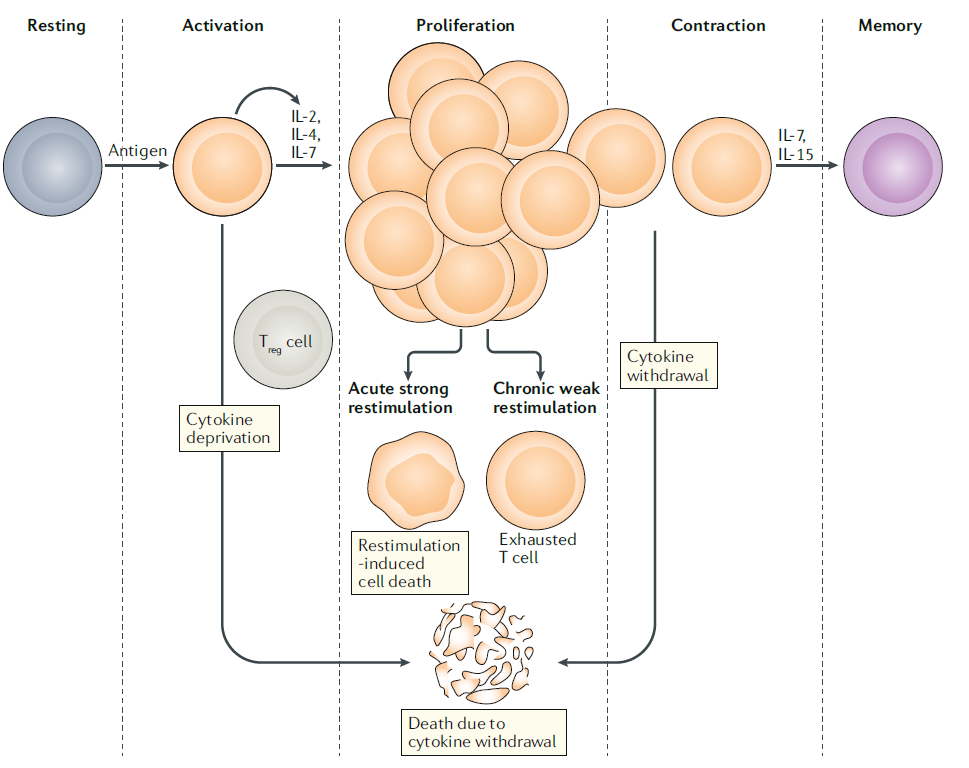
T세포의 활성화 이후의 과정은 3가지로 분류할 수 있습니다. 첫번째로, 면역 반응이 완료되거나 지속적인 고자극으로 인한 세포 사멸로 그 수가 감소합니다. 두번째로는 반복된 저자극으로 인한 T세포의 기능저하로 인해 우리가 흔히 알고 있는 만성감염이나 종양 생성의 과정으로 진입하는 경우입니다. 마지막으로, 활성화된 T세포의 일부는 장기 면역 기억에 참여하는 기억 T세포가 되기도 합니다. 이들은 동일 항원에 노출되었을 때 더 폭발적인 면역 반응을 일으킬 수 있으며, 항원과 암세포에 대한 면역반응의 매개체로서 작용합니다.
최근 분자생물학의 발전에 힘입어, 최근의 단일세포 시퀀싱과 같은 기술을 통해 T세포의 특징과 기능, 특히 종양에 침투할 수 있는 T세포에 대한 연구가 활발히 진행되고 있습니다. 따라서 면역항암치료법은 새로운 타겟과 접근법의 발전을 거듭하고 있으며, 이는 암 정복이 머지 않았음을 시사합니다. 다음으로 이어질 본문에서는 면역관문억제제에 대해서 자세히 알아보겠습니다.
Reference : Waldman AD, Fritz JM, Lenardo MJ. A guide to cancer immunotherapy: from T cell basic science to clinical practice. Nat Rev Immunol. 2020 Nov;20(11):651-668. doi: 10.1038/s41577-020-0306-5.
