지난 글에서 살펴본 바와 같이, 유세포 분석기는 다양한 과학 기술의 융합을 통해 개발되었습니다. 현미경으로는 확인할 수 없었던 단위의 정보들을 수집할 수 있게 되면서, 개별 세포의 표면/내부 특성을 파악할 수 있다는 특장점으로 생물학 전반에서 필수적으로 사용하는 분석 기기로 자리잡았습니다.
Part 1에서는 유세포 분석기의 기본 구성 단위에 대해서 알아보았다면, 오늘 본문에서는 각각의 구성체들을 이용하여 어떻게 데이터를 추출할 수 있는지에 대해서 알아보고자 합니다. 또한 유세포 분석기를 통해 관찰할 수 있는 다양한 생물학적 지표들과 이를 활용할 수 있는 방법들도 정리해보도록 하겠습니다.
유세포 분석기의 기본 원리
1) 형광 염색
각 형광 물질은 빛 에너지를 흡수하는 특정 파장 범위를 갖습니다. 물질이 빛을 흡수하면, 물질의 전자가 바닥 상태에서 들뜬 상태에 이르러 고에너지 상태에 도달합니다. 들뜬 상태의 전자는 빠르게 다시 바닥 상태로 안정화되면서, 초과하여 갖고 있던 에너지를 빛의 광자 형태로 배출합니다. 이러한 에너지의 변환/방출로 인해 우리가 확인하게 되는 광자를 ‘형광’이라고 합니다.
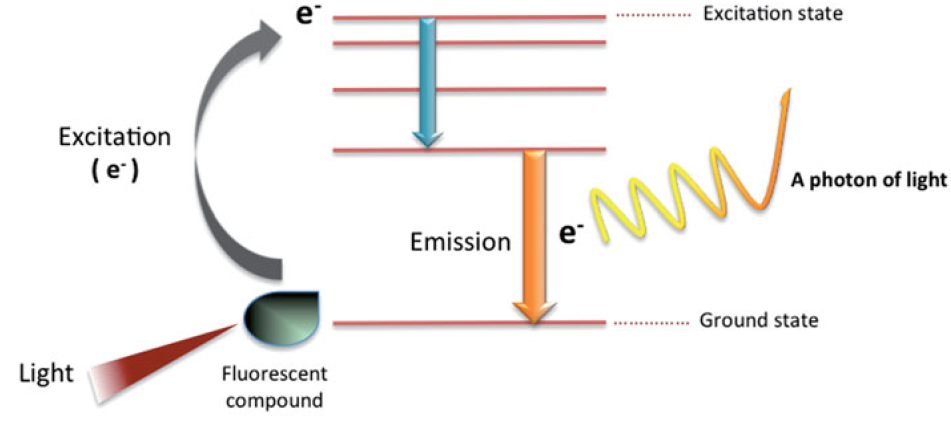
이 때 방출되는 빛의 파장은 흡수되는 빛의 파장보다 항상 길며, 흡수 파장과 방출 파장의 최대값의 차이가 Stoke’s shift입니다. 이는 좋은 형광물질을 평가하는 기준이 되는데, Stoke’s shift가 높으면 높을수록 흡수와 방출 파장의 차이가 커, 이를 분리할 수 있으므로 분석에 간섭 영향이 적어 분석 시 사용하기 좋은 형광물질이라고 할 수 있습니다.
형광 물질을 특정 단백질 등에 부착하면, 세포 표면의 수용체나 세포 내부 기관을 확인하여 단백질 발현도가 서로 다른 세포 집단을 구분할 수 있으며, 특정 세포의 표현형을 확인하거나 핵산량/효소 활성 등을 측정할 수 있습니다. 서로 다른 방출 파장을 갖는 형광 물질들을 한 번에 사용하여 염색할 경우, 최대 14개까지의 서로 다른 단백질의 표지도 가능합니다.
2) 형광 염색법을 이용한 유세포 분석
유세포 분석에서 사용하는 형광 물질은 단백질 염색, 핵산 염색, 리포터 분자로 분류할 수 있습니다. 먼저, 단백질을 염색하기 위한 형광 염료는 표지하고자 하는 단백질과 결합하는 항체에 연결되어 사용됩니다. 항체를 통한 표지에 가장 많이 사용되는 형광 물질은 FITC, PE, APC 등이 있습니다. 보고자 하는 물질, 유세포 분석기에 장착되어 있는 레이저 등을 고려하여 가장 적합한 형광 물질을 찾아 사용하는 것 또한 유세포 분석에서 매우 중요한 포인트입니다. 아르곤 이온 레이저가 탑재된 유세포 분석기를 사용한다면, 기본 형광 물질로 FITC를 사용할 수 있습니다.
FITC는 단백질의 lysine과 쉽게 반응하며, 안정적인 결합체를 형성합니다. FITC의 흡광 파장은 490nm이므로, 단일 색상으로 염색하기에 좋은 형광 염료로 선택할 수 있습니다. 반면, 520nm라는 긴 방출 파장 때문에 다른 형광 염료와 함께 다중 염색을 진행하기에는 적합하지 않습니다. FITC의 형광은 pH에 매우 민감하고 광표백에 취약하다는 단점이 있지만, 이를 극복하기 위해 다양한 FITC 기반 변형체들이 개발되어 다양한 조건에 안정적이면서도 증가한 형광 강도로 단백질을 관찰할 수 있습니다.
PE(495 565/578nm)와 APC(650/660nm)는 phycobiliprotein의 일종이며, 광합성 시스템의 구성 요소입니다. 이들의 흡광도, 그리고 방출하는 형광의 강도는 높은 편입니다. 형광 강도는 FITC와 같은 fluorescein보다 30배 정도 높지만, 실제 염색했을 때에는 FITC 보다 5-10배 정도 높은 형광 강도를 보입니다. 아르곤 레이저 사용 시, FITC와 PE를 모두 흡광시킬 수 있지만 APC의 흡광을 위해서는 헬륨-네온 레이저를 이용하여야 높은 흡광 파장(650nm)를 만족시킬 수 있습니다. 그러나 phycobiliprotein의 단점은 이들의 분자량이 높아, 단백질과 결합하였을 때 구조적 변화를 일으킨다는 것과 적절한 washing 과정이 수행되지 않으면 높은 background를 유발한다는 점입니다.
두 개의 형광 물질을 사용하는 tandem dye의 개발은 단백질을 표지할 수 있는 다양한 방법을 탄생시켰습니다. 대표적인 예로, PE와 APC를 다양한 시아닌 계열의 염료와 결합시킨 복합체를 사용하는 FRET(Fluorescence resonance energy transfer)이 있습니다. FRET은 첫번째 dye가 흡광하여 방출한 빛이 연결된 형광 물질에 전달되고, 이를 통해 연속적인 흡광과 방출이 일어나도록 합니다. 이는 높은 Stoke’s shift를 형성하여 단일 파장의 레이저로 관찰할 수 있는 형광의 범주를 넓힙니다.
핵산 또한 형광 염색을 통해 관찰할 수 있습니다. DNA의 양을 측정하거나, 핵막의 완전성, 핵산의 배수성이나 세포 주기 확인 등에 형광 염색법을 사용합니다. 핵산을 염색하기 위한 가장 보편적인 형광 염료로는 PI를 사용합니다. 이는 DNA의 염기 사이로 삽입되며, 푸른 빛을 흡광하여 붉은 형광색을 방출합니다. 또 다른 염료인 7-ADD는 GC가 풍부한 DNA를 검출하기에 유리하며, 살아있는 세포는 7-ADD를 제거하기 때문에 제거능이 없는 사멸 세포를 염색하는데 사용됩니다. Hoechst와 DAPI의 경우 UV를 흡광하며, AT가 풍부한 DNA 부분에 결합합니다. 이들이 막 투과성 염료이긴 하지만, 사멸 세포들이 이들을 더 쉽게 흡수합니다.
리포터 또한 유세포 분석기에서 자주 사용됩니다. GFP는 488nm의 빛을 흡광하여 초록빛을 내는 형광 단백질이며, GFP를 기반으로 하는 변이체들은 GFP가 도입된 세포들을 분류하는데 사용됩니다. 또 다른 리포터인 JC-1은 미토콘드리아의 막 포텐셜 측정을 위해 사용되며 건강한 세포의 미토콘드리아 내부에 축적, 응집체를 형성하여 590nm의 형광을 방출합니다.
유세포 분석기 데이터의 분석과 활용
1) 데이터 분석법
유세포 분석 데이터를 활용하여 확인하고자 하는 대상을 가시화하는 분석 과정은 생물학 연구에서 중요한 과정 중 하나입니다. 데이터 분석의 주요 목적은 타겟 세포의 특성을 선택적으로 보이게 하는 것과, 해당 세포에 대해 많은 정보를 수치화 할 수 있게 이끌어내는 것입니다. 이러한 방식의 데이터 분석을 ‘gating’이라고 합니다. Gate는 점 도표의 일정 부분을 사용자가 정의하여, 타겟하는 특성을 갖는 세포들만을 분석할 수 있게 합니다. Gating 기법을 통해 분류된 세포의 하위 집단은 수치/그래픽적인 경계로 분류되며, 이렇게 분류된 세포들은 여러 다양한 유형의 도표로 가시화됩니다. 예를 들어, 히스토그램에서 지정한 구역을 2D plot인 점 도표나 등고선, 확률밀도함수 등으로 표현하거나 3D 도표인 단층 그래프로도 나타낼 수 있습니다.
단일 파라미터를 갖는 그래프로는 히스토그램이 대표적입니다. x축은 해당 파라미터에 대한 신호 수치를 나타내고, y축이 각 신호 수치에 대한 이벤트의 수를 표현합니다. x축 상에서 오른쪽으로 갈수록 신호 세기가 큰 것을 의미하며, 가장 이상적인 데이터는 하나의 구분된 peak를 갖습니다. 그러나, 세포의 하위 집단의 분포에 다라 여러 peak의 그래프로 그려질 수도 있습니다.
두개의 파라미터를 갖는 그래프의 경우, 각 파라미터는 x축과 y축에 표시되고 세포의 수는 점의 밀도나 등고선으로 표시합니다. 점 도표의 경우, 각 점은 두 파라미터의 값에 해당하는 한 개의 이벤트를 의미하며 확률밀도함수의 도표는 두 변수에 대한 빈도의 분포를 표현하며, 색을 이용하여 밀도를 표시합니다. 등고선 도표 또한 확률밀도함수 도표와 표현 방식은 같지만, 밀도를 표현하기 위해 색이 아닌 등고선을 사용한다는 점에서 차이를 갖습니다.
2) 데이터의 활용
이러한 유세포 분석 데이터를 활용하면 다양한 세포 특성을 분석할 수 있어, 면역학 등의 생명과학 연구에서 자주 사용됩니다. 가장 대표적으로, 면역표현형 분석 또는 일반 세포의 표현형 분석을 통한 특성 파악은 세포의 종류가 혼합되어 있는 경우 특정 세포 그룹을 확인하고 정량하는데 도움을 줄 수 있습니다. 일반적인 마커로 사용되는 세포 표면의 특정 단백질들에 항체를 부착하여 단백질에 대한 형광 염색 과정을 거친 후, 마커의 발현 여부에 따라 gating을 진행하면 타겟 세포 집단의 정량 분석 등이 가능합니다.
또는, 세포의 생존율을 측정하기 위해 다양한 지표를 사용하여 사멸 세포의 수를 계산하는 데에도 이러한 데이터를 사용할 수 있습니다. 이를 계산하기 위한 측정법은 다음과 같습니다.
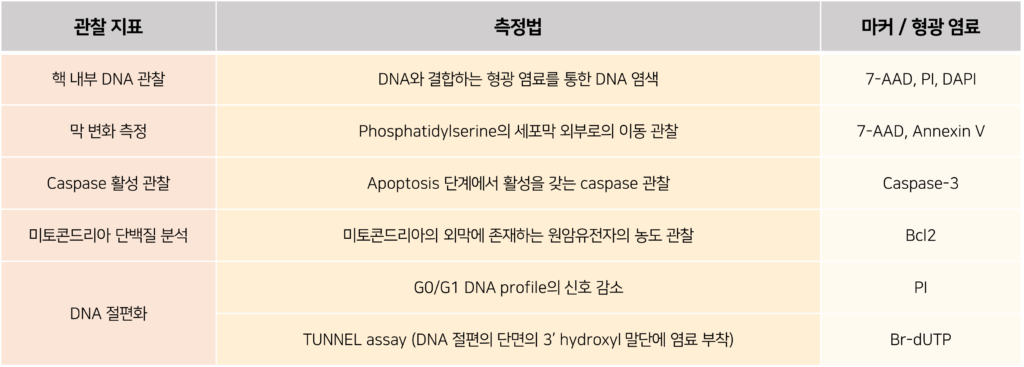
이처럼 다양한 방면에서 이용될 수 있는 유세포 분석 데이터는, 많은 수의 세포를 단시간에 분석할 수 있고 여러 특성들을 한꺼번에 조사할 수 있다는 점에서 매우 효율적인 분석법으로 자리매김하였습니다. 본문에서 소개한 기본적인 실험과 분석 방법 이외에도, 최근에는 양자점(Quantum dot), 미세유체공학(microfluidics)의 발전과 분광 유세포 분석기(Spectral flow cytometry)의 개발로 더욱 정밀한 세포 분석 또는 분류가 가능해졌습니다. 다수의 연구 성과로 인해 새롭게 발견되고 있는 다양한 세포의 종류들을 분석하고, 보다 정밀한 의약품의 효능 평가 등을 위해서는 위와 같은 유세포 분석기의 활용이 좋은 대안이 될 수 있을 것으로 기대됩니다.
참고 문헌 : Adan A, Alizada G, Kiraz Y, Baran Y, Nalbant A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. 2017 Mar;37(2):163-176. doi: 10.3109/07388551.2015.1128876.
